
题目列表(包括答案和解析)
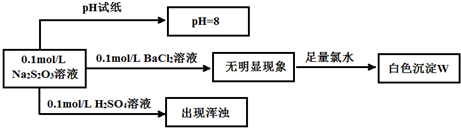
| 实验 序号 |
实验 温度/℃ |
0.1mol/LNa2S2O3溶液的体积/mL | H2O的 体积/mL |
0.1mol/LH2SO4溶液的体积/mL | 所需 时间/s |
| 甲 | 25 | 5 | 5 | 2 | / |
| 乙 | 25 | 5 | 6 | 1 | / |
| 丙 | 35 | 5 | 5 | V | / |
| 编号 | 改变的条件 | 生成SO3 的速率 |
| ① | 降低温度 | |
| ② | 增大氧气浓度 | |
| ③ | 使用负催化剂 | |
| ④ | 压缩体积 |
| 编号 | 实验操作 | 实验的目的 | ||
| ① | 3毫升5%H2O2 | 1-2滴1mol/LFeCl3 | 5℃左右的冷水的烧杯中 | |
| ② | 3毫升5%H2O2 | 1-2滴1mol/LFeCl3 | 40℃左右的热水的烧杯中 | |
| ③ | 2-3毫升3mol/L的HCl溶液 | 5克CaCO3 | CaCO3固体 | 固体的表面积因素对化学反应速率的影响 |
| ④ | CaCO3粉末 | |||
| 编号 | 反应条件 | 反应速率 |
| (1) | 升高温度 | |
| (2) | 加入催化剂 | |
| (3) | 再充入a mol H2 | |
| (4) | 将容器容积扩大为原来2倍 |
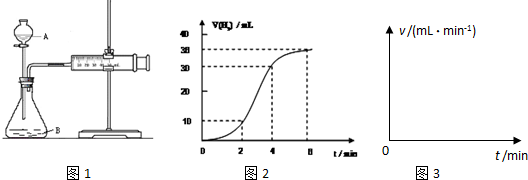
| 编号 | 实验目的 | 锌粒 | 温度 | c(H2SO4) | 需测量的数据 |
| Ⅰ | 为以下实验作参照 | 3粒 | 25℃ | c1 | a |
| Ⅱ | 探究温度对反应速率的影响 | 3粒 | 50℃ | c1 c1 |
b |
| Ⅲ | 探究浓度对反应速率的影响 | 3粒 | 25℃ 25℃ |
c2 | d |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com