
题目列表(包括答案和解析)
①将洗净后的废铁屑放在烧杯内,用过量的工业盐酸浸泡至不再产生气泡,过滤。
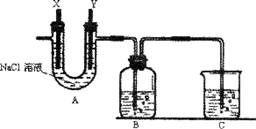
②按下图组装仪器,并检查装置的气密性,将①得到的滤液放入试剂瓶B中。
③在石墨电极X、Y上连接直流电源,通电,待FeCl2全部被氧化后,断开电源。
④试剂瓶B中的溶液经过一系列操作,可得FeCl3·6H2O晶体。
请回答下列问题:

(1)A中的X极应连接电源的___________极,A中发生的化学反应方程式为_____________;B中溶液颜色变化为______________。
(2)C烧杯中应盛放的试剂是______________,其作用是__________________________。
(3)试剂瓶B中的溶液由步骤④制得FeCl3·6H2O晶体,则步骤④需要进行的操作依次是(填序号)______________。
A.加热浓缩 B.洗涤、干燥 C.过滤 D.冷却结晶
(4)在整个实验过程中,盐酸必须保持过量,主要原因是__________________________。
某化学兴趣小组利用细废铁屑制取FeCl3?6H2O晶体。主要步骤如下:
①洗净后的废铁屑放在烧杯内,用过量的工业盐酸浸泡至不再产生气泡,过滤;
②按下图组装仪器,并检查装置的气密性,然后将①得到的滤液放入试剂瓶B中;
③将石墨电极X、Y连接上直流电源,通电,待FeCl2全部被氧化后,断开电源;
④试剂瓶B中的溶液经过一系列实验操作,可得到FeCl3?6H2O晶体。
请回答下列问题:
(1)A中的X极应连接电源的 极,
A中发生反应的化学方程式是 ;
B中溶液颜色的变化是 ;
B中反应的离子方程式是 。
(2)烧杯C中应盛放的试剂是 ,
其作用是 。
(3)试剂瓶B中的溶液由步骤④制得FeCl3?6H2O晶体,步骤④需要进行的实验操作依次是(填序号)
A.蒸发浓缩 B.洗涤 C.过滤 D.冷却结晶
(4)在整个实验过程中,盐酸必须保持过量,主要原因是
。
某化学兴趣小组利用废铁屑制取FeCl3?6H2O晶体。主要步骤如下:
①洗净后的废铁屑放在烧杯内,用过量的工业盐酸浸泡至不再产生气泡,过滤。
② 按下图组装仪器,并检查装置的气密性,将①得到的滤液放入试剂瓶B中。
③ 在石墨电极X、Y上连接直流电源,通电,待FeCl2全部被氧化后,断开电源。
④ 试剂瓶B中的溶液经过一系列操作,可得FeCl3•6H2O晶体。
请回答下列问题:

(1)A中的X极应连接电源的 极,A中发生化学反应的方程式 ;
B中溶液颜色的变化 ,
(2)C烧杯中应该盛放的是 ,其作用是 。
(3)试剂瓶B中的溶液由步骤④制得FeCl3•6H2O晶体,④需要进行的操作依次是(填序号) 。
A.加热浓缩 B.洗涤 、干燥 C.过滤 D.冷却结晶
(4)在整个实验过程中,盐酸必须保持过量,主要原因是 。

| 106(d-b) |
| 44 |
| 106(d-b) |
| 44 |
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用图中的装置进行实验。

主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U形管的质量,得到b g
④从分液漏斗滴入6 mol?L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U形管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g
请填空和完成下列问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明 。
(2)装置中干燥管B的作用是 。
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填“偏高”“偏低”或“不变”)。
(4)步骤⑤的目的是 。
(5)步骤⑦的目的是 。
(6)该试样中纯碱的质量分数的计算式为 。
(7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com