
题目列表(包括答案和解析)
 (1)写热化学方程式:
(1)写热化学方程式:| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
 硫一碘循环分解水制氢主要涉及下列反应:
硫一碘循环分解水制氢主要涉及下列反应: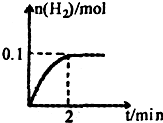
|
一定量的Zn与a mL某浓度的硫酸恰好完全反应,生成气体在标准状况下体积为2.24 L. 则Zn的质量m和反应消耗的H2SO4的物质的量n分别是 | |
| [ ] | |
A. |
m=6.5 g,n=0.1 mol |
B. |
m=13.0 g,n=0.2 mol |
C. |
m=6.5 g,0.1 mol≤n<0.2 mol |
D. |
m=13.0 g,0.1 mol≤n<0.2 mol |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com