高氯酸铜[Cu(C1O
4)
2?6H
2O]易溶于水,120℃开始分解,常用于生产电极和作燃烧的催化剂等.实验室制备少量高氯酸铜的步骤如下:
(1)制备纯净的硫酸铜称取15g粗CuSO
4(含Fe
2+)放入小烧杯中,加入50mL蒸馏水,搅拌.滴入少量稀硫酸,再滴加2mL3%的H
2O
2溶液,充分反应.将溶液冷却,逐滴加入0.5~1mol?L
-1的NaOH溶液,直到pH=3.5~4,过滤,滤液转移到洁净的蒸发皿中,用稀硫酸将溶液pH调至1-2,再经蒸发、结晶、洗涤、晾干得精制的硫酸铜晶体(已知开始沉淀至沉淀完全的pH:Fe
3+为2~3.7,Cu
2+为4.7~6.7).
①加入酸化的过氧化氢溶液,发生反应的离子方程式为
2Fe2++2H++H2O2=2Fe3++2H2O
2Fe2++2H++H2O2=2Fe3++2H2O
.
②用NaOH溶液将溶液pH调至3.5~4,其目的是
使Fe2+完全转化为Fe(OH)3沉淀,而铜离子不沉淀
使Fe2+完全转化为Fe(OH)3沉淀,而铜离子不沉淀
.
(2)依据用(1)制得的精制硫酸铜晶体,制备高纯度的Cu(C1O
4)
2?6H
2O,请补充实验
步骤.该实验可选用的试剂有:70%HClO
4溶液,Na
2CO
3?1OH
2O,盐酸酸化的氯化钡溶液.
a.称取7.0gCuSO
4?5H
2O和8.OgNa
2CO
3?10H
2O,混合研细后,投入100mL沸水,快速搅拌,静置得绿色沉淀.
b.过滤,用少量蒸馏水洗涤沉淀
2-3
2-3
次.
c.用
盐酸酸化的氯化钡
盐酸酸化的氯化钡
检验沉淀是否洗涤干净,
d.在沉淀中慢慢滴加70%HClO
4溶液,搅拌至
刚好不产生气泡
刚好不产生气泡
为止.
e.过滤,得蓝色高氯酸铜溶液.f.在通风橱中蒸发至不再产生白雾,继续蒸发至有晶膜出现,冷却、结晶、过滤、洗涤,得蓝色晶体.
g.60℃下,在烘箱中干燥2h,得Cu(ClO
4)2?6H
2O晶体8.4g.
①补充上述步骤b、c和d.
②本次实验产率为_
80.9%
80.9%
.
③某温度下,高氯酸铜同时按两种方式分解:(A).Cu(ClO
4)
2═CuCl
2+4O
2↑(B).2Cu(ClO
4)
2═2CuO+7O
2↑十+2Cl
2↑
若测得V(O
2)/V(Cl
2)=n,则按(A)式分解的高氯酸铜的质量分数为
(用含n的代数式表示).

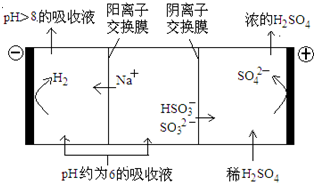 (2012?北京)直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(2012?北京)直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
