现有某铁炭合金,某化学兴趣小组为了测定铁炭合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题.(由实验装置引起的实验误差忽略不计).

Ⅰ.探究浓硫酸的某些性质:
(1)称量E的质量;按照图示连接装置,并检查装置的气密性.
(2)将mg铁炭合金样品放入A中,再加入足量的浓硫酸.未点燃酒精灯前,A、B中均无明显现象,其原因是
常温下,Fe在浓硫酸中钝化;常温下,碳不与浓硫酸反应
常温下,Fe在浓硫酸中钝化;常温下,碳不与浓硫酸反应
.
点燃酒精灯一段时间后,B中(所装试剂为品红溶液)可观察到的明显现象是
品红溶液褪色
品红溶液褪色
、
品红溶液褪色
品红溶液褪色
.
C中(所装试剂为足量酸性KMnO
4溶液)发生反应的化学方程式为
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
.D中盛放的试剂是
浓硫酸
浓硫酸
.
(3)反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还有一种可能的原因是
铁碳在酸溶液中形成原电池
铁碳在酸溶液中形成原电池
.
Ⅱ.测定铁的质量分数:
(4)待A中不再逸出气体时(此时A中无固体剩余),停止加热,拆下E(所装试剂为足量碱石灰)并称重,E增重bg,则铁碳合金中铁的质量分数为
、
(写表达式,装置中残留的气体忽略不计).某同学认为:依据此实验测得的数据,计算出的合金中铁的质量分数可能会偏低,你认为可能的原因是
空气中CO2、H2O进入E管使b增大
空气中CO2、H2O进入E管使b增大
.

(5)经过大家的讨论,决定采用下图装置(干燥管中试剂为无水氯化钙,锥形瓶中为mg铁炭合金和足量稀硫酸.)和其他常用实验仪器测定某些数据即可.为了快速测算出铁的质量分数,最简便的实验操作是
③
③
、
③
③
(填写代号).
①用排水法测定H
2的体积
②反应结束后,过滤、洗涤、干燥、称量残渣的质量
③测定反应前后装置和药品的总质量.

 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定该实验条件下的气体摩尔体积,设计的简易实验装置如图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定该实验条件下的气体摩尔体积,设计的简易实验装置如图.该实验的主要操作步骤如下: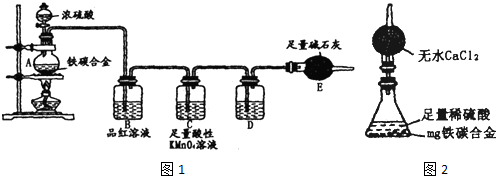

 (5)经过大家的讨论,决定采用下图装置(干燥管中试剂为无水氯化钙,锥形瓶中为mg铁炭合金和足量稀硫酸.)和其他常用实验仪器测定某些数据即可.为了快速测算出铁的质量分数,最简便的实验操作是
(5)经过大家的讨论,决定采用下图装置(干燥管中试剂为无水氯化钙,锥形瓶中为mg铁炭合金和足量稀硫酸.)和其他常用实验仪器测定某些数据即可.为了快速测算出铁的质量分数,最简便的实验操作是