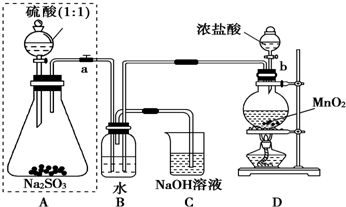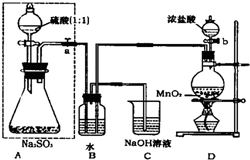
长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来测定亚硫酸钠试剂的被氧化的程度,设计了如图实验:请回答下面的问题:
(1)若将虚线框内的分液漏斗换成长颈漏斗,则应该怎样检查虚线框内装置的气密性?
关闭弹簧夹(或止水夹)a,由长颈漏斗向锥形瓶中加水至漏斗内液面高于锥形瓶内液面,过一段时间观察液面是否变化,若不变,说明气密性好,否则说明装置漏气
关闭弹簧夹(或止水夹)a,由长颈漏斗向锥形瓶中加水至漏斗内液面高于锥形瓶内液面,过一段时间观察液面是否变化,若不变,说明气密性好,否则说明装置漏气
.
(2)D装置中反应的化学方程式为
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑2H
2O
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑2H
2O
B装置中反应的离子方程为
Cl2+SO2+2H2O═4H++2Cl-+SO42-
Cl2+SO2+2H2O═4H++2Cl-+SO42-
.
(3)称量ag Na
2SO
3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl
2溶液充分反应,过滤、洗涤、干燥,得白色沉淀bg,原样品中Na
2SO
3的质量分数为
.
(4)为保证实验测定的准确性,则C装置中反应的离子方程式为:
Cl2+2OH-═Cl-+ClO-+2H2O
Cl2+2OH-═Cl-+ClO-+2H2O
.
(5)现有以下试剂:①蒸馏水、②稀盐酸、③稀硝酸、④BaCl
2溶液、⑤Ba(NO
3)
2溶液,请从中选择合适试剂,
①②④
①②④
设计一种不同的实验方法测定试样中无水亚硫酸钠被氧化的程度
一定质量的Na2SO3样品于试管中,加入适量的蒸馏水溶解,加入过量的稀盐酸,不再产生气泡,再加入足量的BaCl2溶液充分反应,过滤,洗涤,干燥,称重,求算出被氧化的Na2SO3的量,即可求算出无水亚硫酸钠被氧化的百分含量.
一定质量的Na2SO3样品于试管中,加入适量的蒸馏水溶解,加入过量的稀盐酸,不再产生气泡,再加入足量的BaCl2溶液充分反应,过滤,洗涤,干燥,称重,求算出被氧化的Na2SO3的量,即可求算出无水亚硫酸钠被氧化的百分含量.
.

 长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来测定亚硫酸钠试剂的被氧化的程度,设计了如图实验:请回答下面的问题:
长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来测定亚硫酸钠试剂的被氧化的程度,设计了如图实验:请回答下面的问题: