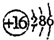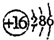(2008?枣庄一模)现有A、B、C、D、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构.
已知:①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的单质以溶于NaOH溶液,向生成的溶液中通入CO
2气体有白色沉淀生成;
③C的氢化物分子G是具有10电子微粒,且以发生下列转化:G
P
Q
M+P;
④E和D是同一主族的元素,二者能形成微粒的个数比为1:2和1:3的化合物T和K;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y.
请回答下列问题:
(1)B元素的名称是
钠
钠
;
(2)E元素的原子结构示意图是
.
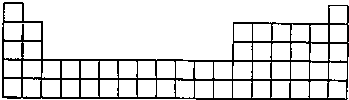
(3)请将A、C的元素符号填在如图所示部分元素周期表的适当位置上.
(4)G的电子式为
.化合物X所含化学键类型有
离子键、共价键
离子键、共价键
.
(5)T与F单质的水溶液反应的离子方程式为
SO2+C12+2H2O=4H++SO42-+2C1-
SO2+C12+2H2O=4H++SO42-+2C1-
;G与D的单质反应的化学方程式为
;M与铜反应的化学方程式为
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O或Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O或Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
.