
题目列表(包括答案和解析)
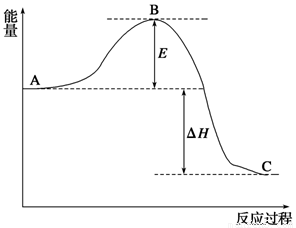
2SO2(g)+O2(g) 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
请回答下列问题:
(1)图中A、C分别表示__________、__________,E的大小对该反应的反应热有无影响?____________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?___________。
(2)图中ΔH=__________kJ/mol;
(3)如果反应速率v(SO2)为0.05 mol/(L·min),则v(O2)=____mol/(L·min)
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH=_ 。
Ⅰ.(6分)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)===nZ(g)+6W(g);2 min末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为 ;2 min末时Y的浓度为 ;化学方程式中n的值是________。
Ⅱ.(8分)将64g铜与200mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为22.4L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液中加入VmL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为 mol·L-1。(用含a、V的的式子表示)
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要往其中加入25%的双氧水 g。
(已知:2NO2+2NaOH=NaNO2+NaNO3+H2O; NO+NO2+2NaOH=2NaNO2+H2O)
(11分)2SO2(g)+O2(g)
 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 molSO3(g)的ΔH=-99 kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 molSO3(g)的ΔH=-99 kJ/mol。

请回答下列问题:
(1) 图中A、C分别表示_____ ___、____ ____,E的大小对该反应的反应热有无影响?________.该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是_____________________________。
(2) 图中ΔH=_____ ___kJ/mol.
(3) V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化.写出该催化循环机理的化学方程式:_____________________ __
_______________________________________________。
(4)如果反应速率v(SO2)为0.05 mol/(L·min),则v(O2)=__________mol/(L·min)、v(SO3)=________ mol/(L·min).
(5) 已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH= 。
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)===nZ(g)+6W(g);2 min末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为____________________;2 min末时Y的浓度为________________;化学方程式中n的值是________。
将5.6 g铁粉投入盛有100 mL 2 mol/L稀硫酸的烧杯中,2 min时铁粉刚好溶解完全。如果反应前后溶液的体积不变,则该反应的平均速率可表示为
A.v(Fe)=0.05 mol/(L·min) B.v(H2SO4)=1 mol/(L·min)
C.v(H2)=0.5 mol/(L·min) D.v(FeSO4)=0.5 mol/(L·min)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com