
题目列表(包括答案和解析)
下列溶液中有关物质的量浓度关系正确的是
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH) < c(CH3COONa) < c(Na2CO3)
B.已知0.1 mol?L-1 二元酸H2A溶液的pH=4,则在0.1 mol?L-1 Na2A溶液中:
c(OH-) = c(HA-) + c(H+) + 2c(H2A)
C.将0.1 mol?L-1醋酸溶液加水稀释,则溶液中的c(H+)和c(OH-)都减小
D.向0.1 mol?L-1的氨水中加入少量硫酸铵固体,则溶液中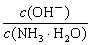 增大
增大
下列各溶液中,微粒的物质的量浓度关系不正确的是 ( )
A.1.0 mol?L-1 Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.1.0 mol?L-1NH4Cl溶液:c(NH4+)<c(Cl-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-)
下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.1.0 mol?L-1Na2CO3溶液:c(OH-) = c(HCO3-) + c(H+) + 2c(H2CO3)
B.1.0 mol?L-1 NH4Cl溶液:c(NH4+) = c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-)
能正确表示下列反应的离子方程式是
A.将0.1 mol?L一Hcl溶液50mL缓缓滴入lmol?L一50mLNa3PO4溶液中,且不断搅拌:3H++PO43一=H3PO4
B.向漂白粉溶液中通入S02气体:Ca2++ZClO一+S02=CaSO3![]() +2HClO
+2HClO
C.向小苏打溶液中加入醋酸HCO3一+CH3C00H=C02t+H2O+CH2COO-
D.稀硝酸中加入过量铜片3Cu+8H-+2No3一=3Cu2++2Not+4H2O
醋酸是我们最熟悉的物质之一,请回答有关问题:
(1)醋酸是电解质,溶于水可以电离成离子,其电离方程式为 ;
(2)向0.5 mol?L-1的某醋酸溶液中,分别加入下列物质,则发生的改变是:
a.一定量的蒸馏水,溶液的PH (填减小、不变或增大,下同);
b.少量NaOH固体,溶液中c(CH3COO-) ;
c.少量CH3COONa固体,溶液中c(H+) ;
d.少量镁粉,溶液中c(CH3COO-) 。
说明:
1. 本答案供阅卷评分使用,试题的参考解答是用来说明评分标准的,考生如按其他方法或步骤解答,正确的同样给分;有错的,根据错误的性质,参照评分标准中相应的规定评分。
2. 化学专用名词中出现错别字、元素符号有错误,都要参照评分标准扣分。
3. 化学方程式、离子方程式未配平的,都不给分。
4. 计算只有最后答案而无演算过程的,不给分。
第Ⅰ卷(选择题,共50分)
一、选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项符合题意)
1. A 2. D 3. B 4. A 5. C 6. D 7. C 8. C 9. D 10. D 11. B 12. C 13. B 14. D 15. A 16. D 17. A 18. C 19. A 20. B 21. B 22. D 23. B 24. C 25. A
第Ⅱ卷(非选择题,共50分)
二、(本题包括4小题,共22分)
26.(共4分)3,28,9,1,14(2分) 0.1(2分)
27.(共6分,每空2分)(1)0.01 mol/(L?s) (2)> 乙
 28.(共3分,每空1分)H2-2e-===2H+
H2+2OH--2e-===2H2O
28.(共3分,每空1分)H2-2e-===2H+
H2+2OH--2e-===2H2O
O2+2H2O+4e-===4OH-
29.(共9分,每空1分)(1)AlCl3 Al2O3 Fe
(2)铝热 焊接钢轨,冶炼钒、铬、锰等金属(答出一种即可)
(3)3Fe+4H2O高温====Fe3O4+4H2
(4)① 2Al+2OH-+2H2O===2AlO-2+3H2↑ ② Al3++3AlO-2+6H2O===4Al(OH)3↓
(5)氨水
三、(本题包括2小题,共15分)
30.(共7分)(1)I-、Fe2+、Al3+(3分) HCO-3、NO-3(2分)
(2)4Fe(OH)2+O2+2H2O===4Fe(OH)3(1分)
(3)AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3(1分)
31.(共8分,每空1分)(1)Mg2++2OH-===Mg(OH)2↓(1分)
(2)碱式滴定管、酸式滴定管(1分) (3)酚酞(1分) 酚酞的变色范围最接近中性,滴定终点时,pH为8.2~10,Mg(OH)2不会溶解,不影响测定结果(1分)
(4)偏低(2分) (5)7.5 %(2分)
四、(本题包括2小题,共13分)
32.(共4分)解:n(Cu)==0.09 mol,n(HNO3)=2.0 mol/L×
==
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O ………………………………(1分)
3 8
=
因为< 所以硝酸过量 ……………………………………(1分)
n(NO)=×n(Cu)=×0.09 mol=0.06 mol ……………………………………(1分)
溶液中n(NO-3)=0.3 mol-0.06 mol=0.24 mol
c(NO-3)==1.6 mol/L ……………………………………………………(1分)
答:溶液中NO-3 的物质的量浓度为1.6 mol/L。
(此题的评分原则是:判断过量2分,算出NO-3 的浓度2分)
 33.(共9分)解:合金溶解于盐酸时所发生的反应有:
33.(共9分)解:合金溶解于盐酸时所发生的反应有:
Mg+2HCl===MgCl2+H2↑,2Al+6HCl===2AlCl3+3H2↑ ………………(1分)
根据图示,加NaOH溶液至130 mL过程中,发生的反应为:
NaOH+HCl===NaCl+H2O MgCl2+2NaOH===Mg(OH)2↓+2NaCl
AlCl3+3NaOH===Al(OH)3↓+3NaCl ………………………………………(1分)
当NaOH溶液由130 mL加至150 mL时,发生的反应为:
Al(OH)3+NaOH===NaAlO2+2H2O …………………………………………(1分)
(1)n(Mg)=n[Mg(OH)2]==0.15 mol ………………………………(1分)
m(Mg)=0.15 mol×
n(Al)=n[Al(OH)3]==0.1 mol ……………………………………(1分)
m(Al)=0.1 mol×
(2)据题意,在加入NaOH溶液130 mL时,溶液中n(Na+)=n(Cl-) …………(1分)
Na+ 全部来自NaOH,Cl- 全部来自盐酸,故n(HCl)=130×10
c(HCl)==6.5 mol/L …………………………………………………(1分)
答:原合金中Al、Mg的质量分别是
(此题的评分原则是:化学方程式或离子方程式共3分,算出铝的质量2分,算出镁的质量2分,算出盐酸的浓度2分。如未写化学方程式或离子方程式,计算结果正确者,镁、铝的质量各3分,盐酸的浓度3分)
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com