
题目列表(包括答案和解析)
在某体积为2 L的密闭容器中充入1.5 mol NO2和2 mol CO,在一定条件下发生反应:NO2+CO=CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol,则:
①此段时间内,用CO2表示的平均反应速率为________
②2 min时,容器内气体的总物质的量为________
③假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量________(填“大于”、“小于”或“等于”)2 min时容器内气体的总物质的量.
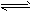 CO2(g)+H2(g) △H<0。CO和H2O浓度变化如图
CO2(g)+H2(g) △H<0。CO和H2O浓度变化如图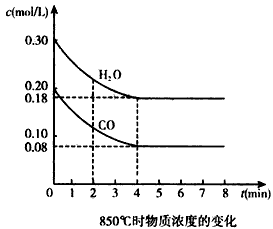
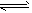 CO2(g)+ H2(g) △H<0。CO和H2O浓度变化如图:
CO2(g)+ H2(g) △H<0。CO和H2O浓度变化如图: 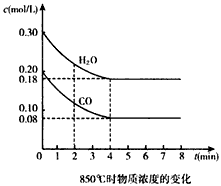
在一体积为10 L的密闭容器中,通入一定量的CO和H2O,在850℃发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);ΔH<0.CO和H2O浓度变化如下图:
CO2(g)+H2(g);ΔH<0.CO和H2O浓度变化如下图:
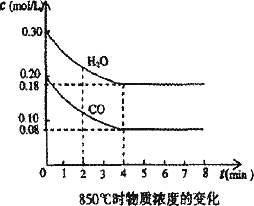
(1)0-4 min的平均反应速率v(CO)=________mol/(L·min).
(2)850℃时,平衡常数K=________.
(3)850℃时,若向该容器中充入1.0 mol CO、3.0 mol H2O,则CO的平衡转化率为________.
(4)能判断该反应达到化学平衡状态的依据是________(填选项序号).
a.容器中压强不变
b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O)
d.c(CO2)=c(CO)
e.容器中气体密度不变
f.1 mol H-H键断裂的同时断裂2 mol H-O键
向容积为2 L的密闭容器中充入2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g) 3C(g);经2 s后达到平衡,测得C气体的浓度为0.6
mol·L-1。下列说法中正确的是
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6
mol·L-1。下列说法中正确的是
① 用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
② 用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③ 平衡时物质A与B的转化率相等
④ 平衡时物质B的浓度为0.2 mol·L-1
A.①②③ B.①③ C.②④ D.①③④
说明:
1. 本答案供阅卷评分使用,试题的参考解答是用来说明评分标准的,考生如按其他方法或步骤解答,正确的同样给分;有错的,根据错误的性质,参照评分标准中相应的规定评分。
2. 化学专用名词中出现错别字、元素符号有错误,都要参照评分标准扣分。
3. 化学方程式、离子方程式未配平的,都不给分。
4. 计算只有最后答案而无演算过程的,不给分。
第Ⅰ卷(选择题,共50分)
一、选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项符合题意)
1. D 2. B 3. C 4. D 5. B 6. D 7. C 8. A 9. A 10. C 11. C 12. B 13. B 14. A
15. D 16. D 17. B 18. A 19. A 20. C 21. C 22. A 23. B 24. C 25. D
第Ⅱ卷(非选择题,共50分)
二、填空题(本题包括6小题,每空1分,共25分)
26.(4分) > > 10-7 mol?L-1 10-14
27.(6分)2 失去2 3 FeS Fe+Cu2+===Fe2++Cu 2Fe+3Cl2点燃=====2FeCl3
28.(4分)→ ← ← ―
 29.(2分)正 氧化
29.(2分)正 氧化
 30.(5分)(1)Al 3 ⅢA (2)钠
30.(5分)(1)Al 3 ⅢA (2)钠
31.(4分)
三、简答题(本题包括3小题,共15分)
32.(共7分,每空1分)(1)2Al+Fe2O3高温=====2Fe+Al2O3 铝(或Al)
(2)大量气泡 2H2O2MnO2======2H2O+O2↑
(3)红 变深 增大任何一种反应物的浓度,都促使化学平衡向正反应方向移动
33.(共4分,每空1分)酸 Fe3++3H2O Fe(OH)3+3H+
盐酸(或HCl)
Fe(OH)3+3H+
盐酸(或HCl)
抑制Ag+ 的水解,防止溶液变浑浊
34.(共4分)(1)气体颜色加深(1分) 气体颜色变浅(1分) (2)升高温度,化学平衡向吸热反应方向移动;降低温度,平衡向放热反应方向移动(2分)
四、计算题(本题包括2小题,共10分)
 35. 解:HNO3+KOH===KNO3+H2O ……………………………………………(1分)
35. 解:HNO3+KOH===KNO3+H2O ……………………………………………(1分)
c(HNO3)?V[HNO3(aq)]=c(KOH)?V[KOH(aq)] ……………………………(1分)
c(HNO3)===0.5018 mol/L (2分)
答:这种HNO3溶液的物质的量浓度为0.5018 mol/L。
36. 解:合金粉末与过量的NaOH溶液混合,只有Al与NaOH反应。
2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 
2×27 g
3×22.4 L
m(Al)
3.36 L …………………………………(2分)
m(Al)= =2.7 g ……………………………………………(2分)
=2.7 g ……………………………………………(2分)
合金中镁的质量分数w(Mg)=×100 %=32.5 % ………………(2分)
答:合金中镁的质量分数为32.5 % 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com