
题目列表(包括答案和解析)
将1mol N2和3 mol H2通入4L的密闭容器中反应,半分钟后测得H2的物质的量为2.1 mol,现用如下三种物质在单位时间内的浓度变化来表示该反应速率。① v(N2) = 0.15 mol/(L?min) ② v(H2) = 1.05 mol/(L?min)
![]() ③ v(NH3) = 0.30 mol/(L?min) 其中正确的是
③ v(NH3) = 0.30 mol/(L?min) 其中正确的是
![]() A.①② B.②③ C.①③ D.①②③
A.①② B.②③ C.①③ D.①②③
用废铁屑与稀硫酸反应,可制得硫酸亚铁。在100C和500C时,FeSO4在 100 g水中的溶解度分别为20.5 g和 48.6g.常温下,从溶液中析出的晶体是FeSO4?7H2O。现取 200 ml 0.500 mol/L H2SO4溶液,将 8.00 g废铁屑加入到上述稀H2SO4中,并不断搅拌,反应约 15 min后过滤。滤液在80℃经蒸发、浓缩,冷却至10℃后析出FeSO4?7H2O晶体。
(1)若加入的废铁不是粉状而是块状,对反应的影响是 。
A.会降低反应速率 B.会减少绿矾产量
C.需要加热才反应 D.将增大反应体系的PH值
(2)反应 15 min后过滤,其目的是 。
(3)滤液中除 FeSO4和可能未反应完全的H2SO4外,最可能存在的无机杂质是 。它是由 而产生的,其检测的方法是 。
(4)设 H2SO4与铁完全反应,当将滤液蒸发浓缩后,冷却至 500C时,溶液的体积约为50.0 ml,该溶液是否达饱和?试通过计算加以说明。(500C时,FeSO4饱和溶液的密度为1.36 g/cm3)
(5)若要计算在800C下将溶液蒸发至体积为70.0 ml,再冷却至100C时,所得到的FeSO4 ?7H2O的质量,你认为 (填编号),并简述所选之理由。答 。
A.前面提供的数据已经足够
B.还需要提供 100C时饱和溶液的密度: 1.42 g/cm3
C.还需要提供 800C时溶液的密度:1.30 g/cm3
D.还需要提供结晶后剩余溶液的体积:52.0 ml
(6)根据第(5)小题你的选择项(如选A则直接计算,如选B、C或D则可选用其数据)计算从100C 50.0 ml溶液中结晶析出的FeSO4?7H2O的质量。(本大题计算结果保留3位有效数字)
在四个不同的容器中,在不同的条件下进行合成氨反应。根据在相同时间内测定的结果判断,生成氨的速率最快的是 ( )
A υ(H2)=0.1 mol?L-1?s-1 B υ(N2)=0.2 mol?L-1?min-1
C υ(NH3)=0.15 mol?L-1?min-1 D υ(H2)=0.3 mol?L-1?min-1
在实验室中做下列实验:把物质A、B按一定比例充入一个表面积为300![]() ,容积为2 L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
,容积为2 L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
2A(g)+B(g)![]() 2C(g);H=-180 kJ?
2C(g);H=-180 kJ?![]()
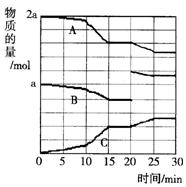 (1)若平均每分钟生成0.5 mol的C,则此反应速率可表示为v(C)=____________;若容器表面向外散热速率平均为400 J?
(1)若平均每分钟生成0.5 mol的C,则此反应速率可表示为v(C)=____________;若容器表面向外散热速率平均为400 J?![]() ?
?![]() ,为了维持恒温t℃,平均每分钟需用加热器提供________kJ的热量;
,为了维持恒温t℃,平均每分钟需用加热器提供________kJ的热量;
(2)反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是_____ ___。
A.10~15 min可能是加入了正催化剂
B.10~15 min可能是降低了温度
C.20 min时可能是缩小了容器体积
D.20 min时可能是增加了B的量
说明:
1. 本答案供阅卷评分使用,试题的参考解答是用来说明评分标准的,考生如按其他方法或步骤解答,正确的同样给分;有错的,根据错误的性质,参照评分标准中相应的规定评分。
2. 化学专用名词中出现错别字、元素符号有错误,都要参照评分标准扣分。
3. 化学方程式、离子方程式未配平的,都不给分。
4. 计算只有最后答案而无演算过程的,不给分。
第Ⅰ卷(选择题,共50分)
一、选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项符合题意)
1. D 2. B 3. C 4. D 5. B 6. D 7. C 8. A 9. A 10. C 11. C 12. B 13. B 14. A
15. D 16. D 17. B 18. A 19. A 20. C 21. C 22. A 23. B 24. C 25. D
第Ⅱ卷(非选择题,共50分)
二、填空题(本题包括6小题,每空1分,共25分)
26.(4分) > > 10-7 mol?L-1 10-14
27.(6分)2 失去2 3 FeS Fe+Cu2+===Fe2++Cu 2Fe+3Cl2点燃=====2FeCl3
28.(4分)→ ← ← ―
 29.(2分)正 氧化
29.(2分)正 氧化
 30.(5分)(1)Al 3 ⅢA (2)钠
30.(5分)(1)Al 3 ⅢA (2)钠
31.(4分)
三、简答题(本题包括3小题,共15分)
32.(共7分,每空1分)(1)2Al+Fe2O3高温=====2Fe+Al2O3 铝(或Al)
(2)大量气泡 2H2O2MnO2======2H2O+O2↑
(3)红 变深 增大任何一种反应物的浓度,都促使化学平衡向正反应方向移动
33.(共4分,每空1分)酸 Fe3++3H2O Fe(OH)3+3H+
盐酸(或HCl)
Fe(OH)3+3H+
盐酸(或HCl)
抑制Ag+ 的水解,防止溶液变浑浊
34.(共4分)(1)气体颜色加深(1分) 气体颜色变浅(1分) (2)升高温度,化学平衡向吸热反应方向移动;降低温度,平衡向放热反应方向移动(2分)
四、计算题(本题包括2小题,共10分)
 35. 解:HNO3+KOH===KNO3+H2O ……………………………………………(1分)
35. 解:HNO3+KOH===KNO3+H2O ……………………………………………(1分)
c(HNO3)?V[HNO3(aq)]=c(KOH)?V[KOH(aq)] ……………………………(1分)
c(HNO3)===0.5018 mol/L (2分)
答:这种HNO3溶液的物质的量浓度为0.5018 mol/L。
36. 解:合金粉末与过量的NaOH溶液混合,只有Al与NaOH反应。
2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 
2×27 g
3×22.4 L
m(Al)
3.36 L …………………………………(2分)
m(Al)= =2.7 g ……………………………………………(2分)
=2.7 g ……………………………………………(2分)
合金中镁的质量分数w(Mg)=×100 %=32.5 % ………………(2分)
答:合金中镁的质量分数为32.5 % 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com