
题目列表(包括答案和解析)
石灰石是我市主要矿产之一,小江同学为了寻找纯度超过85%的石灰石,对一样品进行了如下定量实验。
| 实验步骤 | ①称取烧杯的质量 | ②将适量盐酸加入烧杯中并称重 | ③称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应 | ④待反应完全后,称重 |
| 实验图示 |
| |||
| 实验数据 | 烧杯的质量为50.0 g | 烧杯和盐酸的质量为100.0 g | 石灰石样品的质量为12.0 g | 烧杯和其中混合物的质量为107.6 g |
试通过分析计算:
(1)该实验中生成的二氧化碳的质量是多少克?
(2)该石灰石样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水)
| 甲 | 乙 | 丙 | 丁 | |
| 所取石灰石样品质量/g | 10.0 | 10.0 | 10.0 | 10.0 |
| 加入盐酸的质量/g | 20.0 | 30.0 | 45.0 | 50.0 |
| 剩余固体的质量/g | 6.0 | 4.0 | 2.0 | 2.0 |
| 甲 | 乙 | 丙 | 丁 | |
| 所取石灰石样品质量/g | 10.0 | 10.0 | 10.0 | 10.0 |
| 加入盐酸的质量/g | 20.0 | 30.0 | 45.0 | 50.0 |
| 剩余固体的质量/g | 6.0 | 4.0 | 2.0 | 2.0 |
| 甲 | 乙 | 丙 | 丁 | |
| 所取石灰石样品质量/g | 10.0 | 10.0 | 10.0 | 10.0 |
| 加入盐酸的质量/g | 20.0 | 30.0 | 45.0 | 50.0 |
| 剩余固体的质量/g | 6.0 | 4.0 | 2.0 | 2.0 |
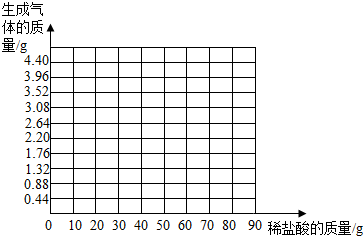
| 盐酸的质量(g) | 10 | 20 | 40 | 60 | 80 |
| 二氧化碳的质量(g) | 0.88 | 1.76 | 3.52 | 4.4 | X |
选择题部分
每题2分,共60分。
题号
答案
题号
13
14
15
16
17
18
19
20
答案
B
C
D
C
A
C
C
D
题号
21
答案
B
非选择题部分
化学部分
一、填空与简答题(每空1分,共20分)
1.SO42- C 碳酸氢钠 硫酸亚铁
2.CH4+2O2 CO2+2H2O;硫化氢;空气(或氧气)
CO2+2H2O;硫化氢;空气(或氧气)
3.66.7%
4.(1) 固体碘和碘蒸气都是由相同的分子构成的;(2)该处的铁不仅与水接触,同时也与空气接触;(3)BaCO3+2HCl===BaCl2+CO2↑+H2O
5.(1)氨气(极)易溶于水;氨气的密度比空气小;氨气会和水发生化学反应,反应后的溶液显碱性;(2)收集到的气体更纯。
6.(1)10 g;(2)低于30℃;(3)冬天气温低,碳酸钠因溶解度减小而结晶析出。
7.加入肥皂水,产生泡沫多的是软水,泡沫少的是硬水;配制溶液。
二、实验探究题(6分)
8.H2O不能使酚酞溶液变红;Na+不能使酚酞溶液变红;成立;将实验①省略;实验②中氯化钠溶液不会使酚酞溶液变红,已经说明了H2O不能使酚酞溶液变色;变红色。
三、计算题(6分)
9.(1)根据质量守恒定律得:m(CO2)=(100.0 g+12.0 g)-107.6 g=4.4 g …(2分)
(2)设12.0 g石灰石样品中含CaCO3质量为x
CaCO3+2HCl===CaCl2+CO2↑+H2O …………………………………(1分)
100 44
x 4.4 g
x= =10.0 g ………
………………………………(1分)
=10.0 g ………
………………………………(1分)
 该石灰石样品的纯度为: 100%=83.3%(或83%) …………………(1分)
该石灰石样品的纯度为: 100%=83.3%(或83%) …………………(1分)
因83.3%<85%,所以该石灰石样品的纯度不符合要求。 ……………………(1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com