
题目列表(包括答案和解析)

| ||
| ||
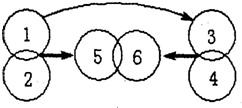 20、有H2SO4、Ba(OH)2、Mg、Na2SO4.四种物质,分别用圆圈代表其中一种物质,相交的圆圈表示能发生化学反应,且反应生成6时有白色沉淀,箭头指向的圆圈表示生成物(有生成物已略去),“→”表示能转化成该物质,试回答:
20、有H2SO4、Ba(OH)2、Mg、Na2SO4.四种物质,分别用圆圈代表其中一种物质,相交的圆圈表示能发生化学反应,且反应生成6时有白色沉淀,箭头指向的圆圈表示生成物(有生成物已略去),“→”表示能转化成该物质,试回答: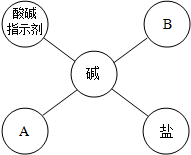 (2012?福建)如图是碱与不同类别物质间反应的关系图.
(2012?福建)如图是碱与不同类别物质间反应的关系图.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com