
题目列表(包括答案和解析)
 (2010?漳州二模)“84”消毒液是一种以次氯酸钠(NaClO)为主的高效消毒剂和漂白剂,被广泛用于医院、宾馆、家庭等的卫生消毒.回答有关问题.
(2010?漳州二模)“84”消毒液是一种以次氯酸钠(NaClO)为主的高效消毒剂和漂白剂,被广泛用于医院、宾馆、家庭等的卫生消毒.回答有关问题.| c(HClO)?c(OH-) |
| c(ClO-) |
| c(HClO)?c(OH-) |
| c(ClO-) |
| ||
| ||
随着经济发展现在汽车越来越多,同时也带来了交通拥挤和空气污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是 ( )
|
B.汽车尾气的主要污染成分包括CO和NO
C.NO和O2必须在催化剂表面才能反应
D.催化转化总反应为NO+O2+CO2 ![]() CO+N2
CO+N2

| ||
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| KSP | 8.0×10-16 | 4.0×10-38 | 3.0×10-17 | 2.2×10-20 |
我国某大型电解铜生产企业,其冶炼工艺中铜、硫回收率达到97%、87%。下图表示其冶炼加工的流程:
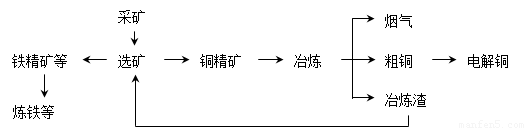
冶炼中的主要反应:Cu2S + O2 = 2Cu + SO2
(1)烟气中的主要废气是________________,从提高资源利用率和减排考虑,其综合利用方式是制___________。
(2)电解法炼铜时,阳极是____________(填“纯铜板”或“粗铜板”);粗铜中含有的金、银以单质的形式在电解槽_______________(填“阳极”或“阴极”的槽底,阴极的电极反应式是_________________________________________。
(3)在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。
几种物质的溶度积常数(KSP):
|
物质 |
Fe(OH)2 |
Fe(OH)3 |
Zn(OH)2 |
Cu(OH)2 |
|
KSP |
8.0×10-16 |
4.0×10-38 |
3.0×10-17 |
2.2×10-20 |
调节电解液的pH是除去杂质离子的常用方法。根据上表中溶度积数据判断,含有等物质的量浓度的Fe2+、Zn2+、Fe3+、Cu2+的溶液,随pH升高最先沉淀下来的离子是______________。
一种方案是先加入过量的H2O2,再调节pH到4左右。加入H2O2后发生反应的离子方程式为___________________________________________________________________________。
某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池,装置如图所示。下列说法不正确的是

A、电流方向为:铝质易拉罐→导线→扬声器→导线→炭棒
B、铝质易拉罐将逐渐被腐蚀
C、电池总反应为:4Al+3O2+6H2O=4Al(OH)3[来源:学§科§网]
D、炭棒上发生的主要反应为:O2+4e-+2H2O=4OH-
1-5、CCABB 6-10、BCAD、BC 11-15、AC、DCCD 16-20、ADDDD 21、D
22【答案】(14分)
(1)Cu、O
(2)b、c
(3)2Fe3++2I-=2Fe2++I2 S2O82-+2Fe2+=2SO42-+2Fe3+(离子方程式不配平不扣分)
(4)a:稀硫酸、KMnO4溶液
b:稀硫酸浸取炉渣所得溶液能使KMnO4溶液褪色
23【答案】(14分)
(1)①铁屑 ②稀硫酸 ③稀硝酸 ④氢氧化钠 ⑤氢氧化钠
(2)Fe+2H+=Fe2++H2↑ 2Fe3++Fe=3Fe2+
Cu2++Fe=Cu+Fe2+ 2Au3++3Fe=2Au+3Fe2+
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3 用作红色涂料 用作制造铜盐的原料
24【答案】(11分)(1)Cu2S (2)Cu2O,Cu2S (3)形成酸雨,会对植物和建筑物造成严重损害 硫酸 硫酸铵 电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液。阳极上发生氧化反应,Cu失去电子,使Cu单质变为Cu2+进入溶液中Cu-2e- === Cu2+;阴极上发生还原反应,Cu2+得到电子在阴极上析出Cu单质,Cu2++2e- === Cu,从而达到精制Cu的目的 (5)A D
25【答案】(8分)(1)Cu + H2O2 + H2SO4 == CuSO4 + 2H2O
(2)4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O 2Fe3+ + 2I― == 2Fe2+ + I2
(3)10KOH + 3Cl2 + 2Fe(OH)3 == 2K2FeO4 + 6KCl + 8H2O
26【答案】(10分)(1)B 目的是除去空气中的水蒸气,避免反应④发生;D 目的是除去空气中的CO2,避免反应③发生;F 目的是除去空气中的O2,避免反应①发生。
(2)j→h→g→d→c→k→l(或l→k)→a→b(或b→a)
(3)制得的氮化镁将不纯 因为A装置没有排完空气前就加热会让空气中的氧气、CO2、水蒸气等与镁反应
(4)将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁
27【答案】(11分)(1)3、4、5、6 Fe-2e-=Fe2+(或2Fe-4e-=2Fe2+) O2+4e-+2H2O=4OH-(2)湿度、温度、O2的浓度、电解质存在 (3)电镀、发蓝等表面覆盖层,牺牲阳极的阴极保护法等(其他合理答案也给分)
28【答案】(1)2Fe3++Cu = 2Fe2++Cu2+。 (2)装置图:
 ;正极反应:Fe3++e- = Fe2+(或2Fe3++2e- = 2Fe2+);负极反应:Cu-2e- = Cu2+。 (3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7;③过滤[除去Fe(OH)3]。 (4)CuO+H2SO4 = CuSO4+H2O、 CuSO4+Fe = FeSO4+Cu;不锈钢表面有紫红色物质生成。
;正极反应:Fe3++e- = Fe2+(或2Fe3++2e- = 2Fe2+);负极反应:Cu-2e- = Cu2+。 (3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7;③过滤[除去Fe(OH)3]。 (4)CuO+H2SO4 = CuSO4+H2O、 CuSO4+Fe = FeSO4+Cu;不锈钢表面有紫红色物质生成。
29【答案】(1)2Al+6H+ = 2Al3++3H2↑或2Al+3Cu2+ = 2Al3++3Cu;
2Cu+O2+H2O+CO2 = Cu2(OH)2CO3。
(2)白色沉淀生成,后沉淀逐渐溶解至消失。
Al3++3OH- = Al(OH)3↓,
Al(OH)3+OH- = AlO2- +2H2O。
(3)①3MnO2+4Al 3Mn+2Al2O3。
3Mn+2Al2O3。
②MnO2+H2O2+2H+ = Mn2++O2↑+2H2O。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com