二甲醚(CH
3OCH
3)和甲醇(CH
3OH)被称为21世纪的新型燃料.以CH
4和H
2O为原料制备二甲醚和甲醇的工业流程如图1:
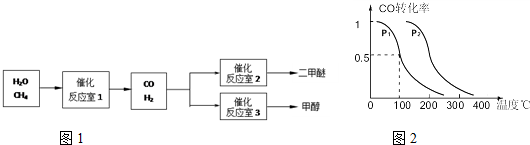
请填空:
(1)在一定条件下,反应室1中发生反应:
CH
4(g)+H
2O(g)?CO(g)+3H
2(g)△H>0.
在其它条件不变的情况下降低温度,逆反应速率将
减小
减小
(填“增大”、“减小”或“不变”).将1.0molCH
4和2.0molH
2O通入反应室1(假设容积为10L),1min末有0.1molCO生成,则1min内反应的平均速率v(H
2)=
0.03
0.03
mol?L
-1?min
-1.
(2)在压强为0.1MPa条件下,反应室3(容积为2L)中0.2molCO与0.4molH
2在催化剂作用下反应生成甲醇:CO(g)+2H
2(g)?CH
3OH(g),CO的平衡转化率与温度、压强的关系如图二所示,则:
①P
1<
<
P
2 (填“<”、“>”或“=”).
②在P
1压强下,100℃时,反应CO(g)+2H
2(g)?CH
3OH(g)的平衡常数K的值为
100
100
若温度不变,再加入1.0molCO后重新达到平衡,则CO的转化率
减小
减小
(填“增大”、“不变”或“减小”)
③在其它条件不变的情况下,反应室3再增加0.2molCO与0.4molH
2,达到新平衡时,CO的转化率
增大
增大
(填“增大”、“不变”或“减小”)




 ,请在方框内写出导致该阶段颜色变化的粒子符号.
,请在方框内写出导致该阶段颜色变化的粒子符号.