
题目列表(包括答案和解析)
(1)常温下,X、Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是__________。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式_______________________________________。
(3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为_______________________________________。
(4)化学反应![]() 2CA3(g)。
2CA3(g)。
当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是________________________。温度为T ℃时,将

(5)化合物A8B4D2有如下转化关系:
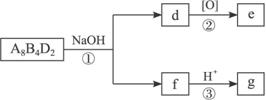
其中,g是常用调味品的主要成分。写出反应①的化学方程式__________________________。
设计实验方案完成d→e的转化____________________________________________________。
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最髙价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4 : 1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为
2 : 1的离子化合物丙。
(1) D的原子结构示意图为 (1分),丙的电子式为 ,E在周期表中的位置为 (2分)。
(2) 下列说法正确的有 (2分)。
①化合物乙为正四面体形分子,是由极性键构成的非极性分子
②C、D、E、F原子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
④化合物甲和化合物丙都含有离子键和共价键
(3) 已知通常状况下1gF在空气中完全燃烧放出a kj的热量,请写出表示F燃烧热的热化学方程式 。将燃烧产物通入BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应 (2 分)。
(4) 写出一个由以上元素构成的1Oe-微粒与18e-微粒反应的离子方程式:
及其他合理答案。
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最髙价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4 :1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为
2 : 1的离子化合物丙。
(1) D的原子结构示意图为 (1分),丙的电子式为 (2分),E在周期表中的位置为 (2分)。
(2) 下列说法正确的有 (2分)。
①化合物乙为正四面体形分子,是由极性键构成的非极性分子
②C、D、E、F原子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
④化合物甲和化合物丙都含有离子键和共价键
(3) 已知通常状况下1gF在空气中完全燃烧放出a kj的热量,请写出表示F燃烧热的热化学方程式 (2分)。将燃烧产物通入BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应 (2 分)。
(4) 写出一个由以上元素构成的1Oe-微粒与18e-微粒反应的离子方程式:
(2分)及其他合理答案。
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最髙价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4 : 1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为
2 : 1的离子化合物丙。
(1) D的原子结构示意图为 (1分),丙的电子式为 (2分),E在周期表中的位置为 (2分)。
(2) 下列说法正确的有 (2分)。
①化合物乙为正四面体形分子,是由极性键构成的非极性分子
②C、D、E、F原子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
④化合物甲和化合物丙都含有离子键和共价键
(3) 已知通常状况下1gF在空气中完全燃烧放出a kj的热量,请写出表示F燃烧热的热化学方程式 (2分)。将燃烧产物通入BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应 (2 分)。
(4) 写出一个由以上元素构成的1Oe-微粒与18e-微粒反应的离子方程式:
(2分)及其他合理答案。
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最髙价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4 : 1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为
2 : 1的离子化合物丙。
(1) D的原子结构示意图为 (1分),丙的电子式为 (2分),E在周期表中的位置为 (2分)。
(2) 下列说法正确的有 (2分)。
①化合物乙为正四面体形分子,是由极性键构成的非极性分子
②C、D、E、F原子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
④化合物甲和化合物丙都含有离子键和共价键
(3) 已知通常状况下1gF在空气中完全燃烧放出a kj的热量,请写出表示F燃烧热的热化学方程式 (2分)。将燃烧产物通入BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应 (2 分)。
(4) 写出一个由以上元素构成的1Oe-微粒与18e-微粒反应的离子方程式:
(2分)及其他合理答案。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com