
题目列表(包括答案和解析)
氯气常用于自来水厂杀菌消毒。
(1)工业上用铁电极和石墨做为电极电解饱和食盐水生产氯气,铁电极作 极,石墨电极上的电极反应式为 。
(2)氯氧化法是在碱性条件下,用Cl2将废水中的CN-氧化成无毒的N2和CO2。该反应的离子方程式为 。
(3)氯胺(NH2Cl)消毒法是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2 + NH3 = NH2Cl + HCl,生成的NH2Cl比HClO稳定,且能部分水解重新生成HClO,起到消毒杀菌的作用。
①氯胺能消毒杀菌的原因是 (用化学用语表示)。
②氯胺消毒法处理后的水中,氮元素多以NH4+的形式存在。
已知:NH4+(aq) + 1.5O2(g)= NO2-(aq) + 2H+(aq) + H2O (l) ΔH=-273 kJ·mol-1
NH4+(aq) + 2O2(g)= NO3-(aq) + 2H+(aq) + H2O (l) ΔH =-346 kJ·mol-1
NO2-(aq)被O2氧化成NO3-(aq)的热化学方程式为 。
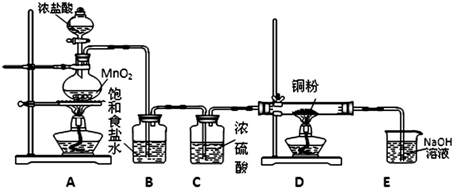
(4)在水产养殖中,可以用Na2S2O3将水中残余的微量Cl2除去,某实验小组利用下图所示装置和药品制备Na2S2O3。
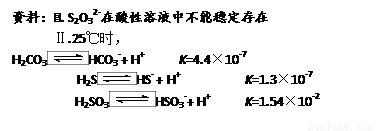
结合上述资料回答:
开始通SO2时,在B口检测到有新的气体生成,判断从B口排出的气体中是否含有H2S,并写出判断依据 。
为获得较多的Na2S2O3,当溶液的pH接近7时,应立即停止通入SO2,其原因是 。
无机化学反应式
1、2Na+2H2O=2NaOH+H2↑ ★ 2K+2H2O=2KOH+H2↑
2、2Na2O2+2H2O=4NaOH+O2↑ 3、2Na2O2+2CO2=2Na2CO3+O2
4、氢氧化钠和碳酸氢钠在溶液中反应的离子方程式为:
OH- +HCO3- =CO32- +H2O
氯气溶于水(新制氯水中含Cl2.HClO.H2O .H+ .Cl - .ClO - .OH-):
5、Cl2+H2O=HCl+HClO ★ Cl2+2NaOH=NaCl+NaClO+H2O
次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂):
6、2HClO![]() 2HCl+O2↑
2HCl+O2↑
7、Ca(ClO)2+CO2+H2O=CaCO3+2HClO
8、MnO2+4HCl(浓)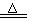 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
9、2F2+2H2O=4HF+O2 Cl2+H2O=HCl+HClO Br2+H2O=HBr+HBrO
10、2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Al2O3+2NaOH=2NaAlO2+H2O
Al(OH)3+NaOH=NaAlO2+2H2O
11、H2O2的分解: 2H2O2![]() 2H2O+O2↑ *H2S与SO2的反应: 2H2S+SO2=3S+2H2O
2H2O+O2↑ *H2S与SO2的反应: 2H2S+SO2=3S+2H2O
12、2SO2+O2![]() 2SO3
2SO3
13、Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
14、C+2H2SO4(浓)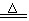 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
15、SiO2+2C![]() Si+2CO↑
Si+2CO↑
16、![]()
17、N2+O2 ![]() 2NO 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
2NO 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
18、4NH3 +5O2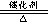 4NO+6H2O
4NO+6H2O
19、用浓盐酸检验氨气(白烟生成): NH3+HCl=NH4Cl
20、(NH4)2SO4+2NaOH Na2SO4+2NH3↑+2H2O
Na2SO4+2NH3↑+2H2O
21、NH4NO3+NaOH=NaNO3+NH3↑+H2O
22、4HNO3![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
23、Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
C+4HNO3(浓)=CO2↑+4NO2↑+2H2O
24、FeCl3+3KSCN![]() 3KCl+Fe(SCN)3
3KCl+Fe(SCN)3
25、盐类水解: CH3COO- +H2O![]() CH3COOH+OH- CO32- +H2O
CH3COOH+OH- CO32- +H2O![]() HCO3-+OH-
HCO3-+OH-
HCO3- +H2O![]() H2CO3+OH- NH4+ +H2O
H2CO3+OH- NH4+ +H2O![]() NH3?H2O+H+
NH3?H2O+H+
Fe3+ +3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
27、铝热反应: 2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
4Al+3MnO2![]() 3Mn+2Al2O3
3Mn+2Al2O3
28、2Mg+CO2![]() C+2MgO
C+2MgO
29、Al2(SO4)3+6NH3·¤H2O=2Al(OH)3↓?+2(NH4)2SO4
30、NaAlO2+HCl+H2O=Al(OH)3↓? +NaCl ; NaAlO2+CO2+H2O=Al(OH)3↓? +NaHCO3
31、高温下铁与水反应 :3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
32、FeCl3+3NaOH=Fe(OH)3↓?+3NaCl
33、4Fe(OH)2+O2+2H2O=4Fe(OH)3
34、2FeCl2+Cl2=2FeCl3 2FeCl3+Fe=3FeCl2
35、氯化铁溶液中加入铜粉: 2FeCl3+Cu=2FeCl2+CuCl2
36、金属的冶炼:Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
CuO+C![]() Cu+CO↑
Cu+CO↑
![]()
37、铜锌原电池:正极:2H++2e- =H2↑
负极:Zn-2e- =Zn2+
38、钢铁的吸氧腐蚀:正极:O2+4e- +2H2O=4OH-
负极:Fe-2e- =Fe2+
39、Fe(OH)3胶体的制取:FeCl3 +3H2O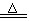 Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
40、电解CuCl2溶液:阳极:2Cl- -2e- =Cl2↑
阴极:Cu2++2e- =Cu
总反应:CuCl2![]() Cu+Cl2↑
Cu+Cl2↑
41、铜的电解精炼:阳极:Cu-2e- =Cu2+
阴极:Cu2++2e- =Cu
42、电镀铜:阳极:Cu-2e- =Cu2+
阴极:Cu2++2e- =Cu
43、电解饱和食盐水:阳极:2Cl- +2e-=Cl2↑
阴极:2H+ +2e- =H2↑
总反应:2NaOH+2H2O![]() H2↑+2NaOH+Cl2↑
H2↑+2NaOH+Cl2↑
44、黄铁矿的燃烧: 4FeS2 +11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
45、氨水吸收少量SO2: SO2+2NH3 +H2O=(NH4)2SO3
46、C+H2O(g)![]() CO+H2
CO+H2
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| 编 号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com