(2010?清远模拟)Fridel-Crafts反应是向苯环上引入烷基最重要的方法,在合成上有很大的实用价值,该反应可以简单表示如下:ArH+RX
ArR+HX;△H<0(Ar表示苯基).某化学兴趣小组在实验室先利用叔丁醇与盐酸反应制得叔丁基氯(沸点50.7℃),再利用Fridel-Crafts反应原理制备对叔丁基苯酚(熔点99℃).反应流程及实验装置如下图所示:
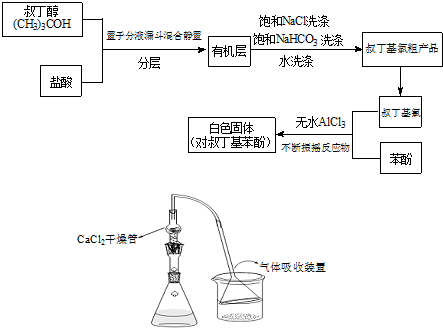
试回答下列问题:
(1)请写出本实验过程中的两个主要化学反应方程式:
(CH3)3COH+HCl→(CH3)3CCl+H2O
(CH3)3COH+HCl→(CH3)3CCl+H2O
,

+(CH
3)
3CCl

+HCl

+(CH
3)
3CCl

+HCl
.
(2)有机层中加入饱和食盐水及饱和碳酸氢钠的作用可能是:
除去叔丁基氯粗产物中的HCl
除去叔丁基氯粗产物中的HCl
.通过
蒸馏
蒸馏
操作可将叔丁基氯粗产物转化为较为纯净的叔丁基氯.
(3)若去掉该制备装置中的氯化钙干燥管,有可能导致的不良后果是(用化学方程式并配合文字说明):
AlCl3+3H2O=Al(OH)3+3HCl↑,催化剂三氯化铝水解变质
AlCl3+3H2O=Al(OH)3+3HCl↑,催化剂三氯化铝水解变质
.
(4)叔丁基氯与苯酚反应时适当控制温度是很重要的.若反应过程中温度过高应用冷水浴冷却,否则可能导致的不良后果是:
反应放热使温度升高,且生成大量的HCl气体,若不及时冷却,叔丁基氯的蒸气易逸出而影响产率
反应放热使温度升高,且生成大量的HCl气体,若不及时冷却,叔丁基氯的蒸气易逸出而影响产率
.
(5)常温下叔丁基氯易于发生消去反应故实验中所用的必须现用现配,试写出叔丁基氯发生消去反应的化学方程式:
(CH3)3CCl→CH2=C(CH3)2+HCl↑
(CH3)3CCl→CH2=C(CH3)2+HCl↑
.
(6)有时候最终产品对叔丁基苯酚不是白色而呈现紫色,你认为可能的原因是:
一部分苯酚被空气中的氧气所氧化
一部分苯酚被空气中的氧气所氧化
.

 I、下表是实验室制备气体的有关内容:
I、下表是实验室制备气体的有关内容: I、下表是实验室制备气体的有关内容:
I、下表是实验室制备气体的有关内容:


 +(CH3)3CCl
+(CH3)3CCl +HCl
+HCl +(CH3)3CCl
+(CH3)3CCl +HCl
+HCl

