
题目列表(包括答案和解析)
研究物质的基本方法主要有________、________、________、________等方法.
A和甲是来自石油和煤的两种基本化工原料.A是气态烃,甲是液态烃.B和D是生活中两种常见的有机物.以A为主要原料合成乙酸乙酯.其合成路线如图所示.
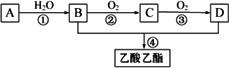
(1)A分子的电子式是________;C的分子式是________.
(2)在反应①~④中,属于加成反应的是________(填序号).
(3)B和D反应进行比较缓慢,提高该反应速率的方法主要有________________;写出反应④的化学反应方程式:________.
(4)可用于鉴别B、D和甲的一种试剂是________.
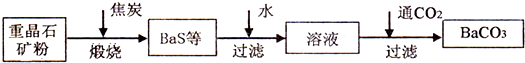
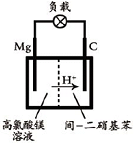 (2012?江苏一模)镁及其合金广泛应用于航空航天、交通、电池等行业,金属镁的制备方法主要有:
(2012?江苏一模)镁及其合金广泛应用于航空航天、交通、电池等行业,金属镁的制备方法主要有: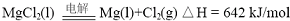
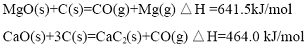
| n(CaC2)/N(MgO) | 还原温度/℃ | 恒温时间/h | 还原率/% |
| 1.1 | 1110 | 2.0 | 62 |
| 1.1 | 1150 | 2.0 | 80 |
| 1.1 | 1150 | 2.5 | 85 |
| 1.2 | 1000 | 2.0 | 33 |
| 1.2 | 1150 | 2.0 | 84 |
| 1.2 | 1150 | 2.5 | 88 |
| 1.3 | 1150 | 2.0 | 86 |
| 1.3 | 1150 | 2.0 | 88 |
| 1100-1250℃ |
| 真空 |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com