
题目列表(包括答案和解析)
(18分)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:
__________,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式_______________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)________。
a.MnO2 b. CuSO4 c.Na2SO3 d.FeCl3
(5)W与④是相邻的同主族元素。在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式。
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3===3H3PO4+H2W↑ |
| 1 |
|
|
| 2 |
|
|
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式______________,
N→⑥的单质的化学方程式为____________,
M溶液中离子浓度由大到小的排列顺序是______________ ,
M中阳离子的鉴定方法 __________。
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:

(1)④、⑤、⑥的原子半径由大到小的顺序是______________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_______________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:________________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.FeCl3
c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X(溶液呈弱酸性)、Y、Z、M、N可发生以下反应:
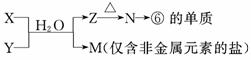
X溶液与Y溶液反应的离子方程式为_________________________________________
________________________________________________________________________,
N→⑥的单质的化学方程式为_____________________________________________,
常温下,为使0.1 mol/L M溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至__________。
(18分)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:
__________,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式_______________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)________。
a.MnO2 b. CuSO4 c.Na2SO3 d.FeCl3
(5) W与④是相邻的同主族元素。在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式。
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3===3H3PO4+H2W↑ |
| 1 | | |
| 2 | | |

(18分)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:

(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:
__________,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式_______________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)________。
a.MnO2 b. CuSO4 c.Na2SO3 d.FeCl3
(5) W与④是相邻的同主族元素。在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式。
|
编号 |
性质 |
化学方程式 |
|
示例 |
氧化性 |
H2WO3+3H3PO3===3H3PO4+H2W↑ |
|
1 |
|
|
|
2 |
|
|
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式______________,
N→⑥的单质的化学方程式为____________,
M溶液中离子浓度由大到小的排列顺序是______________ ,
M中阳离子的鉴定方法 __________。
(16分)下表为元素周期表的一部分,请用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
⑧ |
⑨ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________ ___(用元素符号表示)。
(2)请用化学方程式表示非金属性:②>⑦ _______ ____
(3)表中①、④两种元素的原子可按1:1组成一种具有二元弱酸性质的物质,请写出该物质
的电离方程式: 该弱酸性物质与⑤的最高价氧化物对应的水化物反应时可生成一种酸式盐,该酸式盐的电子式:
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
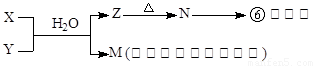
A.X溶液与Y溶液反应的离子方程式为______________ _______,
B.N→⑥的单质的化学方程式为____________ ____。
C.常温下,为了使0.1 mol/L M 溶液中由M电离出的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_____________ ____。
(5)由④、⑤、⑧三中元素形成的化合物溶液中,加入盐酸发生氧化还原反应的离子方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com