
题目列表(包括答案和解析)
 实验室可以用二氧化锰和浓盐酸反应制取氯气,方程式如下:MnO2+4HCl(浓)
实验室可以用二氧化锰和浓盐酸反应制取氯气,方程式如下:MnO2+4HCl(浓)
| ||
. |
由下列反应得出的结论中正确的是
A.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
还原性由强到弱:HCl(浓)>MnCl2
MnCl2+Cl2↑+2H2O
还原性由强到弱:HCl(浓)>MnCl2
B.H2S + CuSO4 = CuS↓+ H2SO4 酸性由强到弱:H2S>H2SO4
C.2KClO3+I2=2KIO3+Cl2 非金属性由强到弱:I>Cl
D.NaAlO2 + NaHCO3 + H2O = Al(OH)3 ↓+ Na2CO3 电离由易到难:Al(OH)3>HCO3-
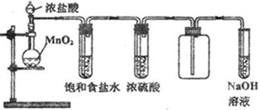
 MnCl2+Cl2↑+2H2O,为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题
MnCl2+Cl2↑+2H2O,为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题
 MnCl2+Cl2↑+2H2O,为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
MnCl2+Cl2↑+2H2O,为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: 
对于反应MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl 2↑,下列说法不正确的是( )
A.该反应是氧化还原反应 B.MnO2是氧化剂
C.HCl是还原剂 D.若生成7.1 g Cl 2,则转移0.1 mol电子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com