
题目列表(包括答案和解析)
 (09山东卷)某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示。据图判断正确的是
(09山东卷)某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示。据图判断正确的是
A.ll为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点KW的数值比c点KW的数值大
D.b点酸的总浓度大于a点酸的总浓度
(09广东卷).(分) 甲酸甲酯水解反应方程式为:
HCOOCH3(l)+H2O(l)![]() HCOOH(l)+CH3OH(l);△H>0
HCOOH(l)+CH3OH(l);△H>0
某小组通过试验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:

(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
| 反应时间范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均反应速率/(10-3mol·min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
请计算15-20min范围内甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率为 mol·min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因: 。
(3)上述反应的平衡常数表达式为:![]() ,则该反应在温度T1下的K值为 。
,则该反应在温度T1下的K值为 。
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
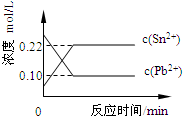 (2011?福建)25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
(2011?福建)25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )![]() (09宁夏卷).(分)碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。
(09宁夏卷).(分)碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。
(1)现采用氢气还原法,请回答如下问题:
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ;
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
 (a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ;
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。
 (09江苏卷)下列有关实验操作的叙述正确的是:
(09江苏卷)下列有关实验操作的叙述正确的是:
A.实验室常用右图所示的装置制取少量的乙酸乙酯
B.用50mL酸式滴定管可准确量取25.00mLKMnO4 溶液
C.用量筒量取5.00mL1.00mol·L-1 盐酸于50mL容量瓶中,
加水稀释至刻度,可配制0.100mol·L-1 盐酸
D.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com