(2009?宿迁模拟)工业合成氨与制备硝酸一般可连续生产,流程如图1:

在800℃、铂催化剂存在条件下,氨与氧气反应的主要产物是NO 和H
2O.在实际生产中氨的氧化率与混合气中氧氨比(氧气与氨气物质的量比,以γ{n(O
2)/n(NH
3)}表示)的关系如图2所示.
请回答下列各题:
(1)若氨氧化率达到100%,理论上γ{n(O
2)/n (NH
3)}为1.25,而实际生产要将γ值维持在1.7~2.2之间,其原因是
一方面提高氧气量,增大氨的氧化率;另方面γ值在该范围,氨的氧化率已高达95~99%,再提高,氨的氧化率上升空间已有限,反而会增加能耗,提高生产成本
一方面提高氧气量,增大氨的氧化率;另方面γ值在该范围,氨的氧化率已高达95~99%,再提高,氨的氧化率上升空间已有限,反而会增加能耗,提高生产成本
.
(2)若使氨的氧化率达到95%,应控制氨在氨、空气混合气体中的体积分数约为
10.5%
10.5%
(设氧气占空气的体积分数为20%).将γ=1.75的氨、空气混合气体通入800℃、盛有铂催化剂的氧化炉,充分反应后导入到吸收塔的气体的主要成分是
N2、NO2、H2O
N2、NO2、H2O
.
(3)现以a mol NH
3和足量空气为原料(不考虑N
2的反应)最大程度制取NH
4NO
3,经过一系列转化反应后,向反应后的混合物中加入b g水,得到密度为ρ g?mL
-1的溶液,计算该溶液中NH
4NO
3物质的量浓度可能的最大值
.


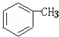 合成一种药物K,其合成路线设计如下:
合成一种药物K,其合成路线设计如下: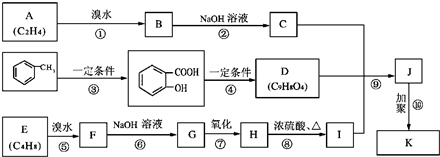






 、
、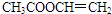 、
、
 、
、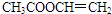 、
、
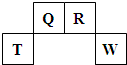 (2009?福建)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
(2009?福建)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
