
题目列表(包括答案和解析)
蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应为NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)该蓄电池放电时,发生还原反应的物质是 (填字母,下同)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)下列有关该电池的说法中正确的是
A.放电时电解质溶液显强酸性
B.放电时5.6g Fe全部转化为Fe(OH)2时,外电路中通过了0.2 mol电子
C.充电时阳极反应为Ni(OH)2+2OH-−2e-==NiO2+2H2O
D.充电时阴极附近溶液的碱性保持不变
(3)用此蓄电池电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100 mL,电解池的电极均为惰性电极。当溶液中的Cu2+ 全部转化成Cu时,阳极产生的气体在标准状况下的体积为 ;将电解后的溶液加水稀释至1L,此时溶液的pH= 。
(4)用此蓄电池进行电解,且电解池的电极均为铜电极,电解质溶液为浓碱液与NaCl溶液的混合液,电解一段时间后,同学们惊奇地发现,阳极附近不是生成蓝色沉淀,而是生成红色沉淀,查阅资料得知该红色沉淀是Cu2O。写出该阳极上的电极反应式: 。
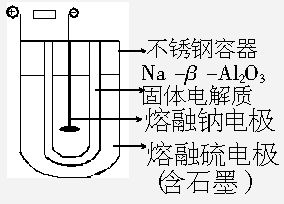 作无噪音、无污染、价廉、安全、使用寿命长以及维修费用低等特点。常用的电池是由液体电解质将两个固体电极隔开,而Na-S电池正好相反,它是由固体电解质将两个液体电极隔开:一个由Na-β-Al2O3固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点113℃)隔开,并允许电子通过。整个装置密封于不锈钢容器内,此容器又兼作硫电极的集流器。在电池内部,电子穿过固体电解质和硫反应从而传递电流。350℃时,Na-S电池的断路电压为2.08V。已知该硫的化学式为S8,在外电路中被还原成多硫离子。
作无噪音、无污染、价廉、安全、使用寿命长以及维修费用低等特点。常用的电池是由液体电解质将两个固体电极隔开,而Na-S电池正好相反,它是由固体电解质将两个液体电极隔开:一个由Na-β-Al2O3固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点113℃)隔开,并允许电子通过。整个装置密封于不锈钢容器内,此容器又兼作硫电极的集流器。在电池内部,电子穿过固体电解质和硫反应从而传递电流。350℃时,Na-S电池的断路电压为2.08V。已知该硫的化学式为S8,在外电路中被还原成多硫离子。Pb+PbO2+4H++![]()
![]() 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):

铅蓄电池示意图
(1)放电时:正极的电极反应式是_________;电解液中H2SO4的浓度将变_________;当外电路通过1 mol电子时,理论上负极板的质量增加_________g。
(2)在完全放电耗尽PbO2和Pb时,若按上图连接,电解一段时间后,则在A电极上生成_________、B电极上生成_________,此时铅蓄电池的正负极的极性将_________。
Ph+PbO2+4H++![]()
![]() 2PbSO4+2H2O
2PbSO4+2H2O
试回答下列问题(不考虑氢、氧的氧化还原):

铅蓄电池示意图
图1-2-17
(1)放电时:正极的电极反应式是________________________________________;
电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO2和Pb时,若按题图连接,电解一段时间后,则在A电极上生成________、B电极上生成________,此时铅蓄电池的正负极的极性将________。
(16分)铅蓄电池是典型的可充型电池,它的正负极是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42-2PbSO4+2H2O
请回答下列问题:
(1)、放电时:正极的电极反应式是________________;正极区PH值将________(填“变大”“变小”“不变”);电解液中H2SO4的浓度将变________;当外电路通过1mol电子时,理论上负极板的质量增加________g。
(2)、在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成________,B电极上生成________,此时铅蓄电池的正负极的极性将________。
(3)、某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:
Cu+H2SO4(稀)=CuSO4+H2↑。
请在方框中画出能够实现这一反应的装置图。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com