
题目列表(包括答案和解析)
(1)上述材料中出现的现象,产生的直接原因是________________污染问题。
(2)八十年代后,这种问题在我国不断加重,试分析其原因。
(16分)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol?L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。
③ 某研究小组为探究提高含硫烟气中SO2的
吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则: ,
有利于提高SO2的吸收效率。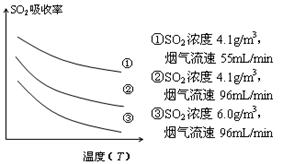
(3)工厂仓库存放的Na2SO3药品已部分被空气
氧化,该化学小组想用已知浓度的酸性KMnO4
溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式___________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是_ (填字母)。

A B C D E
④ 滴定结果如下表所示:
| 滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
(16分)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。2分
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol?L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。2分
③ 某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则: ,有利于提高SO2的吸收效率。2分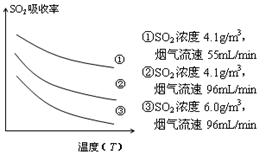
(3)工厂仓库存放的Na2SO3药品已部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式_________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是 (填字母)。

A B C D E
④ 滴定结果如下表所示:
| 滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
一、选择题(本题包括9小题.每小题3分.共27分.每小题只有一个答案正确)
题号
1
2
3
4
5
6
7
8
9
答案
B
D
B
D
B
C
D
D
A
二、选择题(本题包括9小题,每小题4分,共36分.每小题有一个或两个选项符合题意.若
正确答案包括一个选项.多选时.该题为0分;若正确答案包括两个选项,只选一个且正确得2分.选两个且都正确得4分.但只要选错一个,该小题为0分)
题号
10
11
12
13
14
15
16
17
18
答案
AC
C
A
BC
B
AB
C
AD
C
三、(本题包括3小题,共33分)
19.(10分)(1)静置一段时间后.取少量上层澄清溶液再漓加BaCl2溶液,若无沉淀生成,说明SO42-沉淀完全,反之未沉淀完全;(3分)
(2)否,会引入硝酸钾杂质.(2分)
(3)(5分,每处1分。三种或二种物质的缺一种就不给分)。
①KCI、KBr、BaCl2 ② K2CO3 ③BaCO3 ④KCI、KBr、KCO3 ⑤HCL和CL2
20.(11分)(1)0.0020(2分)
 (2)1.8mol?L-1(3分,数据2分,单位1分)
(2)1.8mol?L-1(3分,数据2分,单位1分)
(3)变浅(2分)
(4)D(2分)l(5)60℃曲线(2分)
21.(12分)SO2和品红溶液反应生成无色物质(2分)
(1)①检查装置的气密性(2分); ②KMnO4溶液刚好褪色(2分)
③通入空气至酸性KMnO4溶液刚好褪色所需要的时间 (2分)
(2)①工厂尼气、汽车尾气中SO2音量较高(1分) ②提高脱硫技术(或改用更洁净的能源或提高尾气的处理技术琥对尾气进行综合利用等合理答案均可)(1分)
(3)①:可照是下雨时SO2和水反应降低了雨后空气中SO2的含量(1分);
②:风速越大。气体扩散速度越大。空气中SO2浓度越小(1分)。
四、(本题包括4小题,共44分)
22.(10分)(1)安装好装置并在量气管内加人水,向下移动水准管,静置片刻.若水准管中液面与量气管液面维持一定的高度差,说明装量密封(合理即给分)(2分)
(2)2OH-+2AI+2H2O = 2AIO2-+3H2 ↑ (或写成[AI(OH)4]-)(2分)
(3)0<mal<0.04g(或mal<0.04g,2分) (4)>(2分) (5)符合标准(2分)
23.(14分)(1)排除装置内的空气,w.w.w.k.s.5 u.c.o.m防止NO被空气中的O2氧化(2分)
(2)在C中水蒸气被冷却成液态水,它与NO2或N2O4反应生成N0,干扰NO的验证(2分)
(3)D瓶内气体由无色变为红棕色(1分);2NO+02=2NO2(2分);
(4)把NO2全部转化为N如.晶体.避免在D装置中对N0的验证产生干扰(2分)l防止倒吸(1分)
(5)②用蒸馏水洗涤烧瓶2-3次.洗液也倒人烧杯中(1分),然后加人过量的NaCl溶
液(1分),过滤、洗涤、烘干、称AgCl(1分),计算Ag的质量及质量分数(1分)
24.(10分)
(1)Cu+2HN03+H2S04=CuS04+2N02↑+2H2O(2分)
(2)HNO3(2分)
(3)①
 |
②吸收尾气(2分)
(4)浓硫酸与Cu直接反应需要加热;浓硫酸产生的SO2在此实验中难以循环利用愿料利用率低并污染空气。(2分)
25.(10分)(1)②(1分);酸性KMnO4会氧化C6H5―NH2生成焦油状的复杂物质(1分)
 (2)HOOC- 《 -NO2(2分) (3)聚合(缩聚);加成(2分)
(2)HOOC- 《 -NO2(2分) (3)聚合(缩聚);加成(2分)
(4)C6H5-CH2Cl+NaOH->C6H5-CH20H+NaCl(2分)

(2分)
五、(本题包括2小题,每题10分,但只能选做其中的一题)
26.(10分)(1)HOOC―COOH(1分);羧基、羟基(1分,只答一种不给分) (2)b (1分)
 (3)HOCH2―CH20H+O2
OHC―CHO+2H20(2分)
(3)HOCH2―CH20H+O2
OHC―CHO+2H20(2分)
(4)HOOC―CH2―CH(OH)一COOH H00C―CH=CH―COOH+H2O(2分)
H00C―CH=CH―COOH+H2O(2分)
 |
(5) (2分) (6)2(1分)
27.(10分)(1)I?IIA(1分)
Ⅱ.IVA(1分);b(1分);a点所示的氢化物是水,其沸点高是由于水分子间存在氢键,所以氧族元素中它氢化物的沸点不会高于水。(2分)
(2)I.3d24s2(1分) Ⅱ.①BaTiO3(1分) 6(1分);②[TiCl(H2O)5]Cl2?H2O(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com