
题目列表(包括答案和解析)
(1)18g ![]() 中含有________mol中子,________mol电子.
中含有________mol中子,________mol电子.
(2)据报道,意大利科学家使用普通氧分子和带正电的氧离子作用制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,下列关于O4的说法中不正确的是( )
A.O4与O2、O3互为同素异形体
B.合成O4的反应可看作核聚变反应,不属于化学变化
C.O4分子内存在极性共价键
D.O4的能量比普通氧分子高,预计将来可用作更强力的火箭推进的氧化剂
(3)制备![]() 、
、![]() 甚至
甚至![]() 的化合物是可能的,通常它们是在氧分子进行下列各种反应时生成的:
的化合物是可能的,通常它们是在氧分子进行下列各种反应时生成的:
 ,上述反应中,________相当于氧分子的氧化,________相当于氧分子的还原.
,上述反应中,________相当于氧分子的氧化,________相当于氧分子的还原.
(4)O2(PtF6)是一种含有O2+的化合物,请写出一种含有O2-的化合物的化学式________.
一容器中X元素构成的气态单质X2分子有3种,相对分子质量分别为32、34、36。又知容器中3种分子数之比为15∶4∶1。由此可以确定的是( )
| A.若容器中X2全部转化为它的同素异形体X3,那么X3的分子量有3种 |
| B.质量数为16的一种核素在此容器中的原子百分数为85% |
| C.只要容器中同位素组成不变,X原子在任何条件下发生重新组合,最后得到三种 X2,分子数之比总是15∶4∶1 |
| D.此容器中X2的平均分子量是34 |
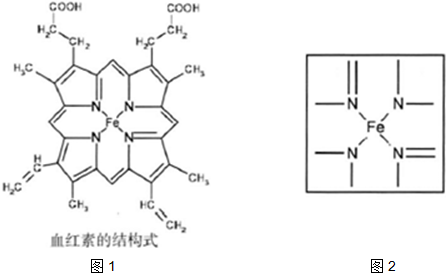
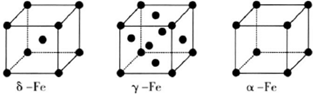
(15分)血红素中含有C、O、N、Fe五种元素。回答下列问题:
⑴C、N、O、H四种元素中电负性最小的是 (填元素符合),写出基态Fe原子的核外电子排布式 。
⑵下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。血红素中N原子的杂化方式有 ,在右图的方框内用“→”标出Fe2+的配位键。
⑶NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
⑷N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是:
![]()
![]()
若该反应中有4molN—H键断裂,则形成的 键有___________mol。
键有___________mol。
⑸根据等电子原理,写出CN—的电子式 , 1 mol O22+中含有的π键数目为 。
⑹铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。
(15分)血红素中含有C、O、N、Fe五种元素。回答下列问题:
⑴C、N、O、H四种元素中电负性最小的是 (填元素符合),写出基态Fe原子的核外电子排布式 。
⑵下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。血红素中N原子的杂化方式有 ,在右图的方框内用“→”标出Fe2+的配位键。
⑶NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
⑷N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是: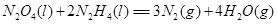
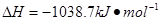
若该反应中有4mol N—H键断裂,则形成的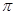 键有___________mol。
键有___________mol。
⑸根据等电子原理,写出CN—的电子式 , 1 mol O22+中含有的π键数目为 。
⑹铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com