
题目列表(包括答案和解析)
某校化学研究性学习小组,在学习金属的冶炼以后对一氧化碳还原金属氧化物的实验非常感兴趣,他们查阅有关资料后发现,一氧化碳的制备可利用甲酸和浓硫酸共热到60~80 ℃发生脱水反应制取:
HCOOH CO↑+H2O
CO↑+H2O
请根据以下各图帮他们组装成一套相对合理的实验装置图(某些装置可重复使用)。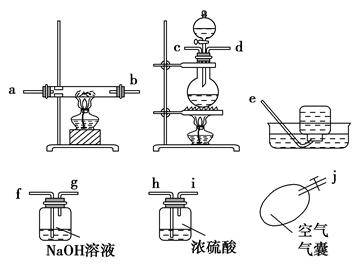
回答以下问题:
(1)合理实验装置的连接顺序是(写小写字母) 。
(2)在反应时一定要先通一会一氧化碳气体,然后再点燃加热氧化铁的酒精灯,原因是 。
| A.因为一般反应从左到右进行 |
| B.排除体系内的空气,使反应过程更安全 |
| C.甲酸与浓硫酸反应可以产生大量的CO |
| D.此反应加热时间长有利于产生CO |
 CO↑+H2O
CO↑+H2O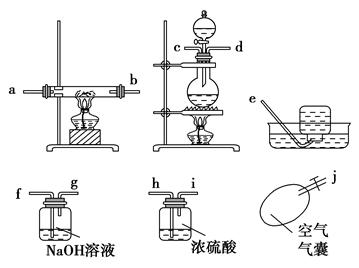
| A.因为一般反应从左到右进行 |
| B.排除体系内的空气,使反应过程更安全 |
| C.甲酸与浓硫酸反应可以产生大量的CO |
| D.此反应加热时间长有利于产生CO |
物质的组成可用不同形式表示.
(1)将下列硅酸盐改写成氧化物的形式(改写时注意金属氧化物在前,非金属氧化物在后,低价在前,高价在后,H2O一般写在后面).
①角闪石棉[Ca2Mg5(Si4O11)2(OH)2]________,
②钾云母[K2H4Al6Si6O24]________.
(2)某型号水泥的主要成分有:Ca2SiOx,Ca3SiOy,Ca3Al2Oz,则x=________,y=________,z=________.
(3)许多含氧酸及其盐类均可以类似硅酸盐形式改写成氧化物形式,请继续改写以下物质:HNO3________,HCOOH________.
通过以上改写可知,HNO3的酸性氧化物为________,HCOOH与浓硫酸反应可制取________气体.
(4)已知在一定条件下.Fe在Cl2中燃烧可以生成Fe3Cl8,它可以看做是FeCl2·2FeCl3,类似地碘与铁在一定条件下可得到Fe3I8,则它可看做是________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com