
题目列表(包括答案和解析)
已知几种难溶电解质的溶度积常数(25℃)见下表
|
| 难溶电解质 | AgCl | AgBr | AgI | Ag2SO4 | Ag2CrO4 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.5×10-17 | 1.4×10-5 | 1.12×10-12 |
| A.Ksp的大小与三种卤化银见光分解的难易无关 |
| B.将等体积的4×10-3mo1?L-1的AgNO3和4×10-3mo1?L-1K2CrO4混合,有Ag2CrO4沉淀产生 |
| C.向AgCl的悬浊液中滴加NaI的饱和溶液可以得到黄色AgI悬浊液 |
| D.100mL0.1mol?L-1的Na2SO4溶液中加入1mL0.1mol?L-1的AgNO3溶液,有白色沉淀生成 |
(Ⅰ)(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2mol/LHCl溶液中由水电离出的c(H+); (填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)= mol/L。
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。(填“>”、“<”、或“=”)
(3) 常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH_________。(填“>7”、“<7”、或“无法确定”)
(Ⅱ)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂。已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定。
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的 。
A. KBr B. KI C. K2S D. K2CrO4
已知一些银盐的颜色及溶解度数值如下:
|
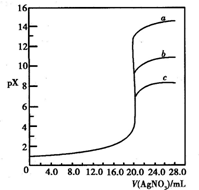 用0.1mol?L-1?AgNO3溶液分别滴定20.00mL含Cl-、Br-、I-浓度均为0.1mol?L-1的溶液,以滴入的AgNO3溶液的体积为横坐标,pX为纵坐标[pX=-lg c(X),X=Cl-、Br-、I-],可得如图所示的滴定曲线.已知25℃时,部分难溶盐的Ksp和颜色如表所示: 用0.1mol?L-1?AgNO3溶液分别滴定20.00mL含Cl-、Br-、I-浓度均为0.1mol?L-1的溶液,以滴入的AgNO3溶液的体积为横坐标,pX为纵坐标[pX=-lg c(X),X=Cl-、Br-、I-],可得如图所示的滴定曲线.已知25℃时,部分难溶盐的Ksp和颜色如表所示:
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com