
题目列表(包括答案和解析)
| |||||||||||||||||||||
(创新)分别取40 mL 0.50 mol/L盐酸与40 mL 0.55 mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
(1)理论上稀强酸、稀强碱反应生成1 mol H2O时放出57.4 kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式:________.
(2)如下图所示,仪器A的名称是________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的ΔH________(填“偏大”、“偏小”或“无影响”).
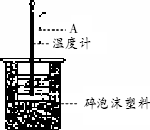
(3)假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g·℃).为了计算中和热,某学生经测定,温度变化平均值为3.1℃,依据实验数据计算,该实验测得的中和热ΔH=________;(结果保留一位小数)
(4)________(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是________.
|
下列叙述中正确的是 | |
| [ ] | |
A. |
凡是强电解质在离子方程式中都要以离子的形式来表示 |
B. |
离子反应一定使溶液中所有离子的浓度都发生变化 |
C. |
复分解反应必须具备离子反应的某个条件 |
D. |
酸碱中和反应都能用离子方程式:H++OH-=H2O表示 |
现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各离子不重复):
阳离子:H+、Na+、Al3+、Ag+、Ba2+ 阴离子:OH-、Cl-、 CO32-、NO3-、SO42-
已知:①A、B两溶液呈碱性,C、D、E溶液呈酸性。
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。
③D溶液与另外四种溶液反应都能产生沉淀。
请回答下列问题:
(1)写出A与D的化学式: A______________,D_______________。
(2)写出A与E溶液反应的离子方程式:____________________________________。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1)△H=-akJ·mol-1.请写出表示相同条件下B与C的稀溶液反应的中和热的热化学方程式:________________。
(4)若25℃时,C、E及醋酸三种溶液的pH=4,则E和C溶液中由水电离出的c(H+)的比是_______________;将C与醋酸混合,醋酸的电离程度将____________(填“增大”“不变”或“减小”)(水的浓度视为常数).
(5)用惰性电极电解0.1mol·L-1 D与0.1mol·L-1C各100mL混合后的溶液,电解一段时间后,阴极质量_________(填“增大”“不变”或“减小”,下同);溶液的pH____________.
(6)向(5)中所得溶液中加入足量铁粉,则所能溶解的铁粉质量为___________g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com