
题目列表(包括答案和解析)
甲醛是世界卫生组织(WHO)确认的致癌物和致畸物质之一。我国规定:室内甲醛(HCHO)含量不得超过0.08mg·m-3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你参与并协助他们完成相关学习任务。
原理:KMnO4 ( H+)溶液为强氧化剂,可氧化甲醛。
离子方程式是:4MnO4―+5HCHO+H+=4Mn2++5CO2↑+11H2O 部分装置如下图所示
步骤:(1)配制1.000×10-4mol/L的KMnO4溶液:第一步:用分析天平称取KMnO4固体1.5800g,配成0.01mol/LKMnO4溶液,除了天平、药匙外,需要的玻璃仪器是: 、 、
、 。第二步:用移液管量取上述已配制的溶液 mL,再用上述用到的仪器配制1.000×10-4mol/L的KMnO4溶液。
(2)测定浓度
①用移液管量取8.00mL 1.000×10-4mol·L-1KMnO4溶液于洗气瓶中,并滴入几滴稀H2SO4,加水20mL稀释备用。
②打开 ,关闭 (填“a”或“b”),用注射器抽取100mL新装修的房屋室内空气。关闭 ,打开 (填“a”或“b”),再推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。重复到第5次注射器推至一半时KMnO4溶液刚好褪色(MnO4-→Mn2+)。
讨论:
(1)计算该居室内空气中甲醛的浓度 mg·m-3,该居室的甲醛 (填是或否)超标。
(2)某同学用该方法测量空气中甲醛的含量时,所测得的数值比实际含量低,探究其可能的原因(假设溶液配制无错误) 。
(3)实验结束后,该小组成员在相互交流的过程中一致认为:实验装置应加以改进:有同学提议,可将插入KMnO4溶液的管子下端改成具有多孔的球泡(右图),有利于提高实验的准确度,其理由是 。
甲醛是世界卫生组织(WHO)确认的致癌物和致畸物质之一。我国规定:室内甲醛(HCHO)含量不得超过0.08mg·m-3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你参与并协助他们完成相关学习任务。
原理:KMnO4 ( H+)溶液为强氧化剂,可氧化甲醛。
离子方程式是:4MnO4―+5HCHO+H+=4Mn2++5CO2↑+11H2O 部分装置如下图所示

步骤:(1)配制1.000×10-4mol/L的KMnO4溶液:第一步:用分析天平称取KMnO4固体1.5800g,配成0.01mol/LKMnO4溶液,除了天平、药匙外,需要的玻璃仪器是: 、 、
、 。第二步:用移液管量取上述已配制的溶液 mL,再用上述用到的仪器配制1.000×10-4mol/L的KMnO4溶液。
(2)测定浓度
①用移液管量取8.00mL 1.000×10-4mol·L-1 KMnO4溶液于洗气瓶中,并滴入几滴稀H2SO4,加水20mL稀释备用。
②打开 ,关闭 (填“a”或“b”),用注射器抽取100mL新装修的房屋室内空气。关闭 ,打开 (填“a”或“b”),再推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。重复到第5次注射器推至一半时KMnO4溶液刚好褪色(MnO4-→Mn2+)。
讨论:
(1)计算该居室内空气中甲醛的浓度 mg·m-3,该居室的甲醛 (填是或否)超标。
(2)某同学用该方法测量空气中甲醛的含量时,所测得的数值比实际含量低,探究其可能的原因(假设溶液配制无错误) 。
(3)实验结束后,该小组成员在相互交流的过程中一致认为:实验装置应加以改进:有同学提议,可将插入KMnO4溶液的管子下端改成具有多孔的球泡(右图),有利于提高实验的准确度,其理由是 。

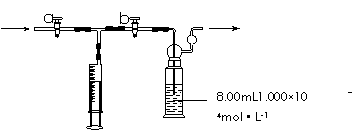 甲醛是世界卫生组织(WHO)确认的致癌物和致畸物质之一。我国规定:室内甲醛(HCHO)含量不得超过0.08mg·m-3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你参与并协助他们完成相关学习任务。
甲醛是世界卫生组织(WHO)确认的致癌物和致畸物质之一。我国规定:室内甲醛(HCHO)含量不得超过0.08mg·m-3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你参与并协助他们完成相关学习任务。
原理:KMnO4 ( H+)溶液为强氧化剂,可氧化甲醛。
离子方程式是:4MnO4―+5HCHO+H+=4Mn2++5CO2↑+11H2O 部分装置如下图所示
步骤:
(1)配制1.000×10-4mol/L的KMnO4溶液:第一步:用分析天平称取KMnO4固体1.5800g,配成0.01mol/LKMnO4溶液,除了天平、药匙外,需要的玻璃仪器是: 、 、
、 。第二步:用移液管量取上述已配制的溶液 mL,再用上述用到的仪器配制1.000×10-4mol/L的KMnO4溶液。
(2)测定浓度
①用移液管量取8.00mL 1.000×10-4mol·L-1 KMnO4溶液于洗气瓶中,并滴入几滴稀H2SO4,加水20mL稀释备用。
②打开 ,关闭 (填“a”或“b”),用注射器抽取100mL新装修的房屋室内空气。关闭 ,打开 (填“a”或“b”),再推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。重复到第5次注射器推至一半时KMnO4溶液刚好褪色(MnO4-→Mn2+)。
讨论:
(1)计算该居室内空气中甲醛的浓度 mg·m-3,该居室的甲醛 (填是或否)超标。
(2)某同学用该方法测量空气中甲醛的含量时,所测得的数值比实际含量低,探究其可能的原因(假设溶液配制无错误) 。
![]() (3)实验结束后,该小组成员在相互交流的过程中一致认为:实验装置应加以改进:有同学提议,可将插入KMnO4溶液的管子下端改成具有多孔的球泡(右图),有利于提高实验的准确度,其理由是 。
(3)实验结束后,该小组成员在相互交流的过程中一致认为:实验装置应加以改进:有同学提议,可将插入KMnO4溶液的管子下端改成具有多孔的球泡(右图),有利于提高实验的准确度,其理由是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com