T、X、Y、Z、Q、R、P、W为周期表前四周期元素,原子序数依次递增,其相关信息如表:
| 元素 |
相 关 信 息 |
| T |
T原子所处的周期数、族序数分别与其原子序数相等 |
| X |
X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z |
Z可形成Z2、Z3两种气态单质 |
| Q |
在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R |
R的离子为单核离子,且离子半径是与其具有相同电子层结构离子中半径最小的 |
| P |
Z是P不同周期的邻族元素;R和P的原子序数之和为30 |
| W |
W的一种核素的质量数为56,中子数为30 |
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是
N>O>C
N>O>C
(用元素符号表示,下同).
(2)T、X两种元素组成的一种化合物M是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则M分子中σ键和π键的个数比为
5:1
5:1
.
(3)将amolQ单质与bmolR单质组成的固体混合物投入到足量的水中,若固体完全溶解最终得到澄清溶液,则同时产生的气体的物质的量为
mol(用a、b表示);当a=b时,写出反应的离子方程式
Na+Al+2H2O=Na++AlO2-+2H2↑
Na+Al+2H2O=Na++AlO2-+2H2↑
.
(4)Y
2T
4分子中Y原子轨道的杂化类型为
sp3杂化
sp3杂化
.Y
2T
4用亚硝酸氧化可生成另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977.写出Y
2T
4与亚硝酸反应的化学方程式
N2H4+HNO2=HN3+2H2O
N2H4+HNO2=HN3+2H2O
;
(5)YT
3的沸点比化合物XT
4的高,其主要原因是:
NH3分子间存在氢键
NH3分子间存在氢键
;
(6)P的单质与T、Z形成的既有极性化学键又有非极性化学键共价化合物反应的离子方程式为
Cl2+H2O2=2H++2Cl-+O2↑
Cl2+H2O2=2H++2Cl-+O2↑
.

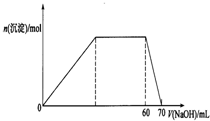
(7)上述八种元素形成的微粒中的两种可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入0.1mol/L氢氧化钠溶液,随着氢氧化钠溶液的加入,产生沉淀的关系如图,则该复盐的化学式为
(NH4)3Al(SO4)3
(NH4)3Al(SO4)3
.


 已知X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大,X元素原子价电子排布式为ns1,Y元素是空气中含量最多的元素,Z 与W同主族,而且W原子的电子排布式中,p轨道上只有1个未成对电子.
已知X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大,X元素原子价电子排布式为ns1,Y元素是空气中含量最多的元素,Z 与W同主族,而且W原子的电子排布式中,p轨道上只有1个未成对电子.
