
题目列表(包括答案和解析)
(15分)氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等。请回答下列问题:
(1)氨气是工业制备硝酸的重要原料,已知下列三个热化学方程式:
① N2 (g)+ 3H2
(g)  2NH3 (g) △H1
2NH3 (g) △H1
② 4NH3(g) +5O2 (g)= 4NO(g) +6H2O(l) △H2
③ N2 (g)+ O2 (g)= 2NO (g) △H
能否应用△H1和△H2表示△H?
若能用△H1和△H2表示△H,则写出△H= ;若不能,说明理由:
。
(2)在相同的温度下,容积相等的两个恒容密闭容器(编号分别为a和b)中,一定量的氮气和氢气发生下列可逆反应:
N2(g)
+ 3H2(g)
 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
实验测得反应起始时各物质的物质的量及平衡时放出的热量如下表:
|
容器编号 |
起始时各物质物质的量/mol |
平衡时反应 |
||
|
N2 |
H2 |
NH3 |
||
|
a |
1 |
3 |
0 |
23.1 |
|
b |
2 |
6 |
0 |
未知(用E表示) |
下列说法正确的是 (填序号)
① 反应a和反应b的氢气转化率相同
②利用已知数据可以计算反应b的平衡常数
③利用已知数据可以计算反应b放出的能量E
④平衡时a、b两个反应的氨气体积分数为1:1
(3)温度为400℃、压强为30Mpa的情况下,密闭容器中发生氢气与氮气的合成氨反应:N2(g)+3H2(g)  2NH3(g)
△H<0 。
2NH3(g)
△H<0 。
氨气的物质的量[n(NH3)]和氢气的物质的量[n(H2)]随时间变化的关系如下图:

正反应速率最大的点是 (选填a、b、c、d中的一个或几个),氮气的物质的量[n(N2)]相等的两点是 (选填a、b、c、d中的两个);保持其他条件不变,将温度改为600℃,在上图中画出反应达到平衡的过程中氨气的变化曲线。
(4)工业合成氨用煤制备原料气氢气时,往往排放大量的二氧化碳。实际工业生成中可利用二氧化碳联合生产二甲醚(CH3OCH3),一定条件下,在容积固定的密闭设备中发生反应:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0
两个密闭恒容容器中在温度均为T且保持不变的情况下进行上述反应,一段时间后测得两个容器中有关数据及正逆反应速率关系如下表:
|
容器 |
c(CO2) /mol·L-1 |
c(H2) /mol·L-1 |
c(CH3OCH3) /mol·L-1 |
c(H2O) /mol·L-1 |
v (正)和v (逆)比较 |
|
容器I |
1.0×10-2 |
1.0×10-2 |
1.0×10-4 |
1.0×10-4 |
v (正)=v (逆) |
|
容器II |
2.0×10-2 |
1.0×10-2 |
1.0×10-4 |
2.0×10-4 |
|
容器I中的反应 (选填“是”或“否”)达到平衡状态,该反应在温度为T时的平衡常数K= 。表格内的空格处v(正)与v(逆)的大小关系是 。

 N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.| 时间/h | 1 | 2 | 3 | 4 | 5 | |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
将不同量的H2O和CO2气体分别通入到一恒容密闭容器中进行反应:
H2O+CO ![]() CO2+H2;得到以下三组数据,据此回答问题
CO2+H2;得到以下三组数据,据此回答问题
实验组 | 温度 | 起始量 | 平衡量 | 达到平衡 所需时间 | ||
H2O | CO | H2 | CO | |||
l | 650℃ | lmol | 2mol | 0.6mol | 1.4mol | 5min |
2 | 900℃ | 0.5mol | 1mol | 0.2mol | 0.8mol | 3min |
3 | 900℃ | a | b | c | d | t |
(1)①由以上数据,实验l中以v (CO2)表示的反应速率为_____________。
②该反应在650℃时平衡常数数值为______,该反应的逆反应为_____(填“吸”或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态,且t<3min,则a,b应满足的关系为:__________。
(2)将0.2mol CO2气体通入到100mL 3mol/L的NaOH溶液中,则所得溶液中各离子浓度关系正确的是____________。
A.c(Na+)>c(HCO3-)>c(OH一)>c(CO32-)>c(H+)
B.c(HCO3-)+c(H2CO3 )+c(CO32-)=2mol/L
C.c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)]
D.c(Na+)+c(H+)=c(OH一)+2c(CO32-)+c(HCO3-)
(3)已知常温下H2CO3为二元弱酸,其第一、二步电离的电离常数分别为![]() 、Ka2,且
、Ka2,且![]() ≈104Ka2。Na2CO3溶液的第一、二步水解反应的平衡常数称为水解常数,分别为Kh1、Kh2。
≈104Ka2。Na2CO3溶液的第一、二步水解反应的平衡常数称为水解常数,分别为Kh1、Kh2。
①请推导出Kh1与Ka2的关系为_________(用表达式表示);
②常温下,0.01mol/L的Na2CO3溶液的pH为_______(用含Kh1的表达式表示)。
实验组 | 温度 | 起始量 | 平衡量 | 达到平衡所需时间 | ||
H2O | CO | H2 | CO | |||
1 | 1 mol | 2 mol | 0.8 mol | 1.2 mol | 5 min | |
2 | 0.5 mol | 1 mol | 0.2 mol | 0.8 mol | 3 min | |
3 | a | b | c | d | t | |
(1)①由以上数据,实验1中以v(CO2)表示的反应速率为___________。
②该反应在
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3 min,则a、b应满足的关系是___________。
(2)下图1、2表示上述反应在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的情况:

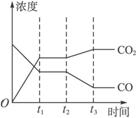
图1 图2
①图1中时刻t2发生改变的条件可能是________________________(写一条即可,下同)。
②图2中时刻t2发生改变的条件可能是__________________________________________。
(3)在
 (I)滴定分析法是化学分析法中的重要分析方法之一.
(I)滴定分析法是化学分析法中的重要分析方法之一.| 滴定次数 实验数据(mL) |
1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |

| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | 常温下过氧化氢溶液不分解(或分解很少) ? ? |
| 实验二 | 在装有H2O2溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 木条复燃 | Al2O3能加快H2O2溶液的分解速率 Al2O3能加快H2O2溶液的分解速率 |

选择题:共21小题.每小题6分。共126分。
一、选择题:选对的给6分.选错或未选的给0分。
1.A 2.D 3.B 4.C 5.D 6.C 7.B 8.A 9.D 10.A
11.B 12.C 13.B
二、选择题(本题包括8小题、共48分。每小题给出的四个选项中,有的只有一个选项正
确.有的有多个选项正确.全部选对的得6分.选对但不全的得3分.有选错的得0分)
14.A 15.D 16.B 17.A 18.BC 19.D 20.BC 21.C
非选择题(共174分)
22.实验题(本题共2小题,共18分.把答案填在题中的横线上或按要求作图)
I.①游标卡尺的读数为
第一次联考(理综).files\image092.jpg) 解:如图所示,
解:如图所示,第一次联考(理综).files\image094.gif) =R/d=tan63°26′06″=2.000,
=R/d=tan63°26′06″=2.000,
∴R=2d=AB,20分度游标卡尺的读数等于AB间距离为12.30mm,
∴被测圆形工件的直径为24.60mm.
②4.600(3分)
Ⅱ.①(4分)
第一次联考(理综).files\image096.jpg) ②
②第一次联考(理综).files\image098.gif) (4分)
(4分)
③“等于”(3分)
设电压表内阻为第一次联考(理综).files\image100.gif) ,先闭合S1,断开S2,
,先闭合S1,断开S2,
第一次联考(理综).files\image102.gif) ;再保持
;再保持第一次联考(理综).files\image104.gif) 不变,闭合S2,
不变,闭合S2,
第一次联考(理综).files\image106.gif)
计算题(共54分)解答时应写出必要的文宇说明、方程式和重要的演算步骤.只写出最后答案的不能得分。有数值计算的题。答案中必须明确写出数值和单位。
23.(16分)解:设两球碰撞后,球的速度分别为第一次联考(理综).files\image108.gif) 、
、第一次联考(理综).files\image110.gif)
由动量守恒定律得:第一次联考(理综).files\image112.gif) ①(4分)
①(4分)
设B球在最高点的速度为第一次联考(理综).files\image114.gif) ,由牛顿第二定律得:
,由牛顿第二定律得:第一次联考(理综).files\image116.gif) ②(4分)
②(4分)
碰后B球运动到F点的过程中,由动能定理得:第一次联考(理综).files\image118.gif) ③(4分)
③(4分)
②代人③得:第一次联考(理综).files\image120.gif)
代入①可得:第一次联考(理综).files\image122.gif) 一
一
方向水平向左 (1分)
24.(18分)解:(1)设水平拉力为F,对框架、cd棒受力分析,
第一次联考(理综).files\image124.jpg) 当框架匀速运动时,对框架有:F=
当框架匀速运动时,对框架有:F=第一次联考(理综).files\image126.gif) +F安(2分)
+F安(2分)
对棒有2第一次联考(理综).files\image071.gif) mg=
mg=第一次联考(理综).files\image126.gif) + F安(3分)
+ F安(3分)
当框架刚开始运动时,对框架由牛顿第二定律得:
F一第一次联考(理综).files\image071.gif) mg=Ma(3分)
mg=Ma(3分)
解出a=第一次联考(理综).files\image131.gif) (2分)
(2分)
(2)设框架做匀速运动的速度大小为第一次联考(理综).files\image133.gif) ,则感应电动势E=BL
,则感应电动势E=BL第一次联考(理综).files\image133.gif) (2分)
(2分)
回路中的电流:I=第一次联考(理综).files\image136.gif) (2分)
(2分)
对框架由力的平衡得:F=BIL+第一次联考(理综).files\image071.gif) mg (2分)
mg (2分)
联立以上各式解出:第一次联考(理综).files\image138.gif) (2分)
(2分)
25.(20分)解:(1)粒子经过电场加速后,设进入磁场的速度为第一次联考(理综).files\image140.gif)
第一次联考(理综).files\image142.jpg)
第一次联考(理综).files\image144.gif) (3分)
(3分)
得:第一次联考(理综).files\image146.gif) (1分)
(1分)
粒子在磁场中做圆周运动,设半径为r,第一次联考(理综).files\image148.gif) (3分)
(3分)
得:r=2R (1分)
设粒子运动的圆心为点E,圆心角为2第一次联考(理综).files\image036.gif) ;
;第一次联考(理综).files\image151.gif) (2分);
(2分);
∠CGF=2第一次联考(理综).files\image036.gif) ,FC=(4R一R)tan2
,FC=(4R一R)tan2第一次联考(理综).files\image036.gif) 一3R×
一3R×第一次联考(理综).files\image153.gif) (3 分);
(3 分);
第一次联考(理综).files\image155.jpg) 故F点坐标为(4R;4R)
故F点坐标为(4R;4R)
(2)当圆形磁场整体转动时,粒子做圆周运动的圆心和轨迹都不变。
当磁场区将粒子的轨迹覆盖最长时,即粒子在磁场中的圆弧轨迹
对应的弦长等于磁场的直径2R,此时粒子的出射速度与z轴的偏
角最大,粒子打在光屏上的点距C点最远。(3分)(若论证不充分,
只要图中画出圆形磁场的直径是粒子轨迹的弦,同样得分。)
△OBE为等边三角形,有:第一次联考(理综).files\image157.gif)
得:第一次联考(理综).files\image159.gif) (2分)
(2分)
故得最大距离:第一次联考(理综).files\image161.gif) (2分)
(2分)
说明:计算题其它解法正确的均给分。
第一次联考(理综).files\image163.jpg)
26.(14分) (1) (2分)
(2)C(2分) 原子晶体(2分)
(3)Cl2+2OH一=Cl一十ClO一+H2O (4分)
(4)阴(2分) 0.1(2分)
27.(14分)(1)过滤(2分),漏斗,玻璃棒(各1分,共2分)
(2)Cu(2分)
(3)因为Hg有挥发性,且有毒。(2分)
(4)Cu+H2O2+H2SO4=CuSO4+2H2O(4分)
(5)冷却结晶(或结晶)(2分)
28.(14分)(1)0.16(2分)
(2)>(3分),<(3分)
(3)b=
(4)B、C(2分)
29.(18分)(1)C7H6O4(2分) 羟基、羧基(每空1分,共2分) 第一次联考(理综).files\image165.jpg)
②保护酚羟基,防止其被氧化 (2分)
③a、b (2分)
第一次联考(理综).files\image167.jpg)
30.(每空2分,共18分)
(3)实验步骤
I.②实验组 对照组
Ⅱ.②大小一致和饱满程度相同的黄豆种子 ③相同的环境下
(4)结果预测与分析
①A组的种子萌发数量和长度与B组相比都有所减少
②A组的种子萌发数量和长度与B组相比都有所增加
洗发水对种子萌发和生长都有一定的促进作用
③A组的种子萌发数量和长度与B组基本相同
洗发水对种子萌发和生长基本没有影响
31.(每空2分,共24分)
I.(1)黄毛、尾弯曲 黄毛、灰毛
(2)BB
(3)BbXTXt
(4) ①显性 ②体
(5)乙 乙突变体的蛋白质中氨基酸的改变比甲突变体可能更多(或:甲突变体的蛋
白质可能只有一个氨基酸发生改变,乙突变体的蛋白氨基酸序列可能从第一个氨
基酸后都改变)。
II.(1)O2释放 CO2吸收速率
(2)光照强度降低,光反应速率降低
“光斑”照耀期间积累的ATP和NADPH还可以使暗反应持续一段时间
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com