
题目列表(包括答案和解析)
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206.0kJ?molˉ1
CO(g)+3H2(g) △H=+206.0kJ?molˉ1
II:CO(g)+2H2(g) CH3OH(g) △H=-129.0kJ?molˉ1
CH3OH(g) △H=-129.0kJ?molˉ1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为 。
(2)将1.0mol CH4和1.0mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图。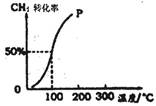
①假设100℃时达到平衡所需构时间为5min,则用H2表示该反应的平均反应速率为 。
②1000C时反应I的平衡常数为 。
(3)在压强为0.1 MPa、温度为300℃条件下,将a molCO与2a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器舶容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
| A.平衡常数K增大 | B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH的物质的量增加 | D.重新平衡c(H2)/c(CH3OH)减小 |

 CO(g)+3H2(g) △H=+206.0kJ?molˉ1
CO(g)+3H2(g) △H=+206.0kJ?molˉ1 CH3OH(g) △H=-129.0kJ?molˉ1
CH3OH(g) △H=-129.0kJ?molˉ1
| A.平衡常数K增大 | B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH的物质的量增加 | D.重新平衡c(H2)/c(CH3OH)减小 |
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (K) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
 SO2Cl2(l) △H=–97.3kJ·mol—1
SO2Cl2(l) △H=–97.3kJ·mol—1Ⅰ.电离平衡常数(用K表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
|
化学式 |
HF |
H2CO3 |
HClO |
|
电离平衡常数 (K) |
7.2×10-4 |
K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的下列四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。
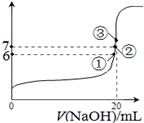
(2)25℃时,在20mL0.1mol·L—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_______。

A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol·L—1
(3)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-akJ·mol—1,
②H+(aq)+OH-(aq)=H2O(l) ΔH=-bkJ·mol—1,
氢氟酸的电离方程式及热效应可表示为________________________。
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与等物质的量的H2O反应得到HF和化合物A,则每生成1molHF转移_______mol电子。
Ⅱ.氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点–54.1℃,沸点69.1℃。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
SO2(g)+Cl2(g) SO2Cl2(l) △H=–97.3kJ·mol—1
SO2Cl2(l) △H=–97.3kJ·mol—1
(1)试写出常温常压下化学平衡常数K的表达式:K=_________________;
(2)对上述反应,若要使化学平衡常数K增大,化学反应速率v正也增大,可采取的措施是_____(选填编号)。
a.降低温度 b.移走SO2Cl2
c.增加反应物浓度 d.无法满足上述条件
(3)下列描述中能说明上述反应已达平衡的是____________(选填编号)。
a.υ(Cl 2)=υ(SO2) b.容器中气体压强不随时间而变化
c.c(Cl 2) : c(SO2)=1:1 d.容器中气体颜色不随时间两变化
(4)300℃时,体积为1L的密闭容器中充入16.20g SO2Cl2,达到平衡时容器中含SO2 7.616g。若在上述中的平衡体系中,再加入16.20g SO2Cl2,当再次达平衡时,容器中含SO2的质量范围是________________________。
现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各离子不重复):
阳离子:H+、Na+、Al3+、Ag+、Ba2+ 阴离子:OH-、Cl-、 CO32-、NO3-、SO42-
已知:①A、B两溶液呈碱性,C、D、E溶液呈酸性。
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。
③D溶液与另外四种溶液反应都能产生沉淀。
请回答下列问题:
(1)写出A与D的化学式: A______________,D_______________。
(2)写出A与E溶液反应的离子方程式:____________________________________。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1)△H=-akJ·mol-1.请写出表示相同条件下B与C的稀溶液反应的中和热的热化学方程式:________________。
(4)若25℃时,C、E及醋酸三种溶液的pH=4,则E和C溶液中由水电离出的c(H+)的比是_______________;将C与醋酸混合,醋酸的电离程度将____________(填“增大”“不变”或“减小”)(水的浓度视为常数).
(5)用惰性电极电解0.1mol·L-1 D与0.1mol·L-1C各100mL混合后的溶液,电解一段时间后,阴极质量_________(填“增大”“不变”或“减小”,下同);溶液的pH____________.
(6)向(5)中所得溶液中加入足量铁粉,则所能溶解的铁粉质量为___________g。
第Ⅰ卷(选择题21题,每题6分,共126分)
一、选择题(本题包括13小题。每小题只有一个选项最符合题意)
题号
1
2
3
4
5
6
7
8
9
答案
B
C
B
B
A
D
C
B
A
题号
10
11
12
13
14
15
16
17
答案
B
B
B
C
B
C
C
D
二、选择题(本题共4小题。在每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得6分,选对但选不全的得3分,有选错的得0分)
题号
18
19
20
21
答案
CD
BD
BD
CD
第Ⅱ卷(非选择题10题,共174分)
22.(Ⅰ)4π
(Ⅱ) (1)
(1)

23.解:(1)设杆运动到竖直位置时,A、B两球的速度均为 ,
,
对A、B系统,由机械能守恒: 得
得
对B球: 得
得
所以杆对B球有向上的支持力,则杆对A有向下的压力
对A球: 得
得
所以A球对轨道的压力大小为 ,方向竖直向下。
,方向竖直向下。
(3)要使轻杆到达竖直位置时,杆上恰好无弹力作用,B球需满足:
对A、B系统应用机械能守恒:
解得  .
.
24.解:(1)开始滚轮给铁板向右的滑动摩擦力: 
工作台给铁板向左的摩擦力: 
铁板先向右做匀加速运动,加速度: ,
,
加速过程中铁板达到的最大速度: ,
,
这一过程铁板的位移: ,
,
此后滚轮给铁板的摩擦力将变为静摩擦力,铁板将做匀速运动.在加速运动过程中,
由 ,得
,得 ,
,
匀速运动过程的位移为 ,
,
由 ,得
,得 ,
,
所以加工一块铁板所用的时间为: .
.
(2)电动机对外做的总功:

则加工一块铁板电动机输出的平均功率: .
.
25.解:(1)ab棒做匀速直线运动,说明它受到的安培力与滑动摩擦力是一对平衡力,故有
: =
= 所以:
所以:
 即:
即:

当ab棒匀速运动时,说明它所受到的安培力不变,也就是回路的感应电动势不变,此时cd棒也在做匀速运动,它受到的外力等于它受到的安培力和滑动摩擦力之和,由于ab棒和cd棒中的电流相同,长度相同,在同一磁场中,它们受到的安培力大小相等,方向相反,
所以:
作用在cd上的拉力F的功率为P,
(2)当cd棒突然停止运动,而ab棒做切割磁感线的运动,所产生的感应电流在磁场中受到安培力(方向与刚才相反)和滑动摩擦力的共同作用使ab棒做减速运动,直到停止,此过程是一个加速度减小的减速运动,令△S是ab棒运动时扫过的面积, 是与此面积相对应ab棒滑动的距离.
是与此面积相对应ab棒滑动的距离.
则:

所以: 
此过程中克服摩擦力的功为 :
由能量守恒可知两金属棒上消耗的电能共为:

26.(15分)
(1) (3分)
(3分)
(2) 0.008 (2分)
(2分)
0.1[或0.1 ] (2分) 逆反应 (2分)
] (2分) 逆反应 (2分)
(3)①氨在水中溶解度大,使溶液呈碱性,有利于吸收 ,
,
增大 ,促使
,促使 转化为
转化为 ,同时生成
,同时生成 (2分)
(2分)
②CaO(或生石灰)  (或二氧化碳)
(各2分,共4分)
(或二氧化碳)
(各2分,共4分)
27.(10分)(1)NaOH(2分)
 (2)①2Na2O2+2CO2 2Na2CO3+O2(2分)
②2Mg+CO2
(2)①2Na2O2+2CO2 2Na2CO3+O2(2分)
②2Mg+CO2 2MgO+C (2分)
2MgO+C (2分)
(3)3MgCO3?Mg(OH)2或Mg4(OH)2(CO3)3等;(2分)
 3MgCO3?Mg(OH)2+8HCl 4MgCl2+3CO2↑+4H2O(2分)
3MgCO3?Mg(OH)2+8HCl 4MgCl2+3CO2↑+4H2O(2分)
28.(15分)
 (1)2FeSO4?7H2O Fe2O3+SO2↑+SO3+14H2O(其它合理答案均给分)(3分)
(1)2FeSO4?7H2O Fe2O3+SO2↑+SO3+14H2O(其它合理答案均给分)(3分)
(2)SO2为大气污染物,缺少尾气处理装置(2分)
(3)3CH3CH2OH+Fe2O3
 2Fe+3CH3CHO+3H2O(其它合理答案均给分)(3分)
2Fe+3CH3CHO+3H2O(其它合理答案均给分)(3分)
(4)关闭活塞K,将E的导气管插入水中,微热C管,E中有气泡产生,停止加热后,E管出现一段水柱,说明装置不漏气(2分)
(5)防止倒吸(2分)
(6)CH3CHO+2Ag(NH3)2OH
 CH3COONH4+2Ag↓+3NH3
+H2O (3分)
CH3COONH4+2Ag↓+3NH3
+H2O (3分)
 |
29.(1)①nCH3COOCH=CH2 (2分)
 ②CH3COOCH2CH2Br + 2NaOH
CH3COONa + HOCH2-CH2OH + NaBr(2分)
②CH3COOCH2CH2Br + 2NaOH
CH3COONa + HOCH2-CH2OH + NaBr(2分)
 (2)甲酸 (2分)
(2)甲酸 (2分)
(3)①CH2=CHCOOH + CH3OH CH2=CHCOOCH3 + H2O (2分) ace(2分)
② HCHO;CH3COOH;CH2OH(CHOH)4CHO(全对给2分,错1个不得分写不全给1分)


 (4) (2分) (2分) (2分)
(4) (2分) (2分) (2分)
30.Ⅰ(10分)(l)氧气释放速率急剧上升,二氧化碳吸收速率上升相对缓慢 (2分)
(2)光合作用速率与呼吸作用速率相等(2分)
(3) 随着光斑的移开,光照强度降低到原有水平,光反应速率下降 (2分)
光斑形成期间积累大量的ATP和NADPH ,可以使暗反应持续一段时间(2分)
(4)光照强度、CO2吸收速率(暗反应的速率)(2分)
Ⅱ.(14分)a. (1) 消化吸收 (1分) (2) 血糖被氧化分解 (1分)
(3) 胰岛素 (1分) 促进糖元合成等(1分) 胰高血糖素(1分)
肝糖元分解 (1分)
b. (1) 对照 (1分)
(2) 更多氨基酸分解,含氮部分转变成尿素的量增加(2分)
(3) ② 增加(2分)血糖含量过高,在排出糖的同时,带走更多的水,导致多尿(2分)
31.(20分)(以下评分标准仅供参考)
(1)把灰身残翅雌果蝇和黑檀体长翅雄果蝇放入同一容器中培养,使其交配并产生后代。(2分)(3)子一代雌雄果蝇相互交配产卵。子二代幼虫将要成熟时,将子一代个体移走。幼虫成熟后观察其性状并记录。(2分)
(4)统计分析F2代的各种表现型,得出实验结论。(2分)
实验结果和相应的结论:
若F2代没有黑体出现,说明黑体是不可遗传变异(1分), 同理没有残翅出现,说明残翅是不遗传变异(1分);反之则是可遗传变异(基因突变)。(1分)
若F2代中出现灰身长翅、灰身残翅、黑檀体长翅和黑檀体残翅4种表现型(1分),且比例接近9:3:3:1(1分),则说明两对性状的遗传遵循自由组合定律。(1分)
若F2代中出现上述4种表现型(1分),但比例不接近9:3:3:1(1分),则说明两对基因的遗传不符合自由组合定律。(1分)
若F2代中黑檀体果蝇全是雄性(1分),灰身既有雄性、又有雌性(1分),则说明控制灰体黑檀体的基因位于X染色体上,按伴性遗传规律遗传(1分);若与性别无关,则是常染色体遗传。(1分)
根据亲代与F1代的关系说明控制长翅和残翅的基因位于常染色体上。(1分)
本资料由《七彩教育网》www.7caiedu.cn 提供!
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com