
题目列表(包括答案和解析)
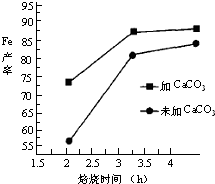 利用生产钛白的副产品绿矾(FeSO4?7H2O)制备还原铁粉的步骤如下:将绿矾溶于稀硫酸溶液,向其中滴加(NH4)2CO3溶液,得到FeCO3?nH2O沉淀,静置,过滤,洗涤,干燥,再将FeCO3与煤粉一起焙烧,最终制得还原铁粉.涉及的主要反应有:
利用生产钛白的副产品绿矾(FeSO4?7H2O)制备还原铁粉的步骤如下:将绿矾溶于稀硫酸溶液,向其中滴加(NH4)2CO3溶液,得到FeCO3?nH2O沉淀,静置,过滤,洗涤,干燥,再将FeCO3与煤粉一起焙烧,最终制得还原铁粉.涉及的主要反应有:
| ||
| ||
| ||
下表为周期表前20号元素中某些元素的有关数据:
| 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
原子半径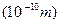 | 1.86 | 1.52 | 0.66 | 1.43 | 0.77 | 1.10 | 0.99 | 2.31 | 0.70 | 0.64 |
| 最高价态 | +1 | +1 | —— | +3 | +4 | +5 | +7 | +1 | +5 | —— |
| 最低价态 | —— | —— | -2 | —— | -4 | -3 | -1 | —— | -3 | -1 |
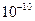 m,该元素在周期表中的位置是
m,该元素在周期表中的位置是 下表为周期表前20号元素中某些元素的有关数据:
|
元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径 |
1.86 |
1.52 |
0.66 |
1.43 |
0.77 |
1.10 |
0.99 |
2.31 |
0.70 |
0.64 |
|
最高价态 |
+1 |
+1 |
—— |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
—— |
|
最低价态 |
—— |
—— |
-2 |
—— |
-4 |
-3 |
-1 |
—— |
-3 |
-1 |
试回答下列问题:(以下各题回答,可能的话,均用对应的元素符号或物质的化学式表示)
(1)写出⑦⑨与氢元素形成的常见离子化合物的电子式
(2)上述⑤、⑥、⑦号元素中某2种元素形成的化合物中,每一个原子都满足最
外层为8电子稳定结构的物质可能是 、 ;
(3)某元素R的原子半径为1.04× m,该元素在周期表中的位置是
m,该元素在周期表中的位置是
(4)以上10种元素的原子中,失去核外第一个电子所需能量最少的是
(5)④、⑦、⑧、⑩四种元素形成的离子,其半径由小到大的顺序为
(12分)在一固定容积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)CO(g)+H2O(g);△H= Q KJ/mol其化学平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答:
(1)上述反应中Q 0 (选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是 。
a. 容器中压强不变 b. 反应热不变 c. v正(H2) =v逆(CO) d. CO2的质量分数不变
(3)温度为850℃时,可逆反应CO(g)+H2O(g)CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:
850℃时物质的浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c 2 | c 3 | c 3 |
| 4 | c 1 | c 2 | c 3 | c 3 |
| 5 | 0.116 | 0.216 | 0.084 |
|
| 6 | 0.096 | 0.266 | 0.104 |
|
①计算:3 min时CO的浓度 c 1 = mol/L,H2O (g)的转化率= 。
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是 表中5min~6min之间数值发生变化, 可能的原因是
a . 增加水蒸气 b. 降低温度 c. 使用催化剂 d. 增加氢气浓度
(12分)在一固定容积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g);△H= Q KJ/mol其化学平衡常数K和温度t的关系如下:
CO(g)+H2O(g);△H= Q KJ/mol其化学平衡常数K和温度t的关系如下:
|
t℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答:
(1)上述反应中Q 0 (选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是 。
a. 容器中压强不变 b. 反应热不变 c. v正(H2) =v逆(CO) d. CO2的质量分数不变
(3)温度为850℃时,可逆反应CO(g)+H2O(g) CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:
850℃时物质的浓度(mol/L)的变化
|
时间(min) |
CO |
H2O |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c 2 |
c 3 |
c 3 |
|
4 |
c 1 |
c 2 |
c 3 |
c 3 |
|
5 |
0.116 |
0.216 |
0.084 |
|
|
6 |
0.096 |
0.266 |
0.104 |
|
①计算:3 min时CO的浓度 c 1 = mol/L,H2O (g)的转化率= 。
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是 表中5min~6min之间数值发生变化, 可能的原因是
a . 增加水蒸气 b. 降低温度 c. 使用催化剂 d. 增加氢气浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com