
题目列表(包括答案和解析)
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol?L-1) | 0.10 | a | 0.026 | 0.0065 |
| 滴定次数 实验数据 |
1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |
| V(NaOH)/mL(消耗) | 14.98 | 15.00 | 15.02 | 15.95 |
| V(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 |
| 溶液pH | 2.88 | 4.70 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 |
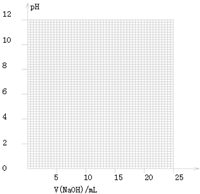
| 指示剂 | 变色的范围(pH) |
| 甲基橙 | 3.1~4.4 |
| 石蕊 | 5.0~8.0 |
| 酚酞 | 8.2~10.0 |
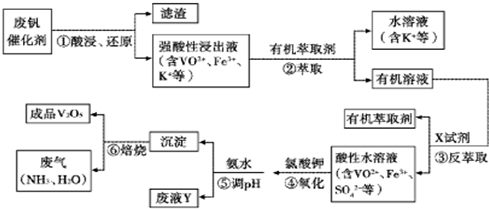
- 3 |
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钡沉淀率/% | 88 | 92 | 93 | 95 | 95 | 95 | 93 | 90 | 87 |
 在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙两个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热(Q),及平衡时的转化率(X)如下表所示:
在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙两个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热(Q),及平衡时的转化率(X)如下表所示:| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2 | O2 | SO3 | N2 | |||
| 甲 | 2 | 1 | 0 | 0 | Q1 | X1 |
| 乙 | 1 | 0.5 | 0 | 1 | Q2= 39.4 |
X2 |
| t 1-t 2 | t 3-t 4 | t 4-t 5 | t 6-t 7 |
| K1 | K2 | K3 | K4 |
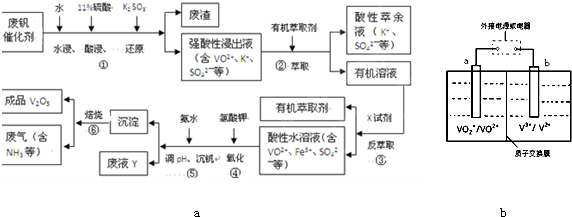
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
| 放电 |
| 充电 |
一、二选择
题号
1
2
3
4
5
6
7
8
9
10
11
答案
C
C
C
D
C
B
C
B
C
A
C
题号
12
13
14
15
16
17
18
19
20
21
22
答案
D
C
AD
A
AC
ABC
CD
C
A
C
 22.Ⅰ.
22.Ⅰ.  不变
不变
Ⅱ.电压表V2读数U2
待测电压表V读数U
电阻箱读数R1 (3分)
RV =UR1/U2-U (3分)
(电路图5分)
23. (2分)
(2分)
 (5分)
(5分)
 (3分)
(3分)
ρ (3分)
ρ
(3分)
ρ (3分)
(3分)
24.(1).由受力可判断金属杆先做加速度减小的加速运动,后做匀速运动。
可知: (5分)
(5分)  (5分)
(5分)  (2分)
(2分)
(2) (7分)
(7分)
25.由动量定律有: (6分)
(6分)
由动能定律有: (6分)
(6分)

 (4分)
(4分)
解得: (4分)
(4分)
 26、(1)C (或碳) O(或氧) (2)SO2+2OH-=SO32-+H2O
26、(1)C (或碳) O(或氧) (2)SO2+2OH-=SO32-+H2O

(3)
(4)H++HSO3-=H2O+SO2↑(5)分子(每空2分,共14分)
27、(每空3分共15分)(1)Na2O2 3NO2+H2O=2HNO3+NO
(2)酸性 NH4++H2O NH3•H2O+H+
NH3•H2O+H+
(3)NaOH(l)+HNO3(l)=NaNO3(l)+H2O(l); ΔH=-57.3kJ/mol
28、(1)6.4mL(2分) (2)10mL量筒(1分) 250mL容量瓶 (2分)
(3)玻璃棒 表面皿(或玻璃片)(2分) 弱酸(或弱电解质)(1分)
(4)碱式 (1分) 锥形瓶(1分) 0.06mol/L(2分) 偏高(1分)
29.(本题共18分)(每空2分,共18分)
(1)a、CH3CH2CH2COOH b、CH3CH2COOCH3
(2)羟基、醛基 CH3COCH2COOH
(3)a; b、c (4)CH3CHOHCH2CHO → CH3CH=CHCHO+H2O

 (5) nCH3CH=CHCH2OH →
(5) nCH3CH=CHCH2OH →
(6)
30.(每空2分,共24分)
(1) ① 提高 ; 在失重或微重力环境下原生质体相与的机会增加,所以更容易发生融合。
②沿水平方向,根和茎向相反的方向生长(或沿水平方向生长也可) ;
应激性 ; 适应
③基因突变
由于辐射、失重(强的宇宙射线也可)等原因使基因内的碱基排列顺序发生改变。
(2)①基因突变 ②母系遗传 , 后代无一定的性状分离比。
③大量死亡 ④不赞成 ; 抗虫棉不能抵抗所有的害虫。
31.(每空2分,共18分)
(1)一只纯种雄性(雌性)长翅果蝇 ; 一只雌性(雄性)残翅果蝇
(2)自由交配 ; 甲组:在每一代中都要除去残翅果蝇,然后让长翅果蝇自由交配。 乙组:不做任何处理,其它培养条件与实验组相同。
(3)甲、乙两组子七代中长翅果蝇和残翅果蝇在各自种群中的百分比
(4)残翅果蝇 ; B和b基因在各自种群中的基因频率(却一个基因扣一分)
(5)这种人工选择将导致B基因频率增大,b基因频率减小。(却一个基因扣一分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com