
题目列表(包括答案和解析)
| ||
| ||
| 65Y |
| 16X |
| 65Y |
| 16X |
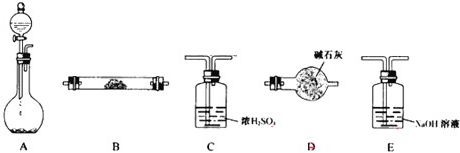
 如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为
如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:

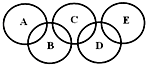 如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为
如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为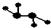 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题: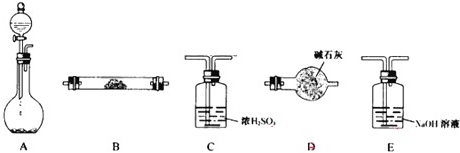
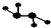 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题: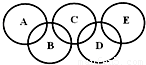
一、二选择
题号
1
2
3
4
5
6
7
8
9
10
11
答案
C
C
C
D
C
B
C
B
C
A
C
题号
12
13
14
15
16
17
18
19
20
21
22
答案
D
C
AD
A
AC
ABC
CD
C
A
C
 22.Ⅰ.
22.Ⅰ.  不变
不变
Ⅱ.电压表V2读数U2
待测电压表V读数U
电阻箱读数R1 (3分)
RV =UR1/U2-U (3分)
(电路图5分)
23. (2分)
(2分)
 (5分)
(5分)
 (3分)
(3分)
ρ (3分)
ρ
(3分)
ρ (3分)
(3分)
24.(1).由受力可判断金属杆先做加速度减小的加速运动,后做匀速运动。
可知: (5分)
(5分)  (5分)
(5分)  (2分)
(2分)
(2) (7分)
(7分)
25.由动量定律有: (6分)
(6分)
由动能定律有: (6分)
(6分)

 (4分)
(4分)
解得: (4分)
(4分)
 26、(1)C (或碳) O(或氧) (2)SO2+2OH-=SO32-+H2O
26、(1)C (或碳) O(或氧) (2)SO2+2OH-=SO32-+H2O

(3)
(4)H++HSO3-=H2O+SO2↑(5)分子(每空2分,共14分)
27、(每空3分共15分)(1)Na2O2 3NO2+H2O=2HNO3+NO
(2)酸性 NH4++H2O NH3•H2O+H+
NH3•H2O+H+
(3)NaOH(l)+HNO3(l)=NaNO3(l)+H2O(l); ΔH=-57.3kJ/mol
28、(1)6.4mL(2分) (2)10mL量筒(1分) 250mL容量瓶 (2分)
(3)玻璃棒 表面皿(或玻璃片)(2分) 弱酸(或弱电解质)(1分)
(4)碱式 (1分) 锥形瓶(1分) 0.06mol/L(2分) 偏高(1分)
29.(本题共18分)(每空2分,共18分)
(1)a、CH3CH2CH2COOH b、CH3CH2COOCH3
(2)羟基、醛基 CH3COCH2COOH
(3)a; b、c (4)CH3CHOHCH2CHO → CH3CH=CHCHO+H2O

 (5) nCH3CH=CHCH2OH →
(5) nCH3CH=CHCH2OH →
(6)
30.(每空2分,共24分)
(1) ① 提高 ; 在失重或微重力环境下原生质体相与的机会增加,所以更容易发生融合。
②沿水平方向,根和茎向相反的方向生长(或沿水平方向生长也可) ;
应激性 ; 适应
③基因突变
由于辐射、失重(强的宇宙射线也可)等原因使基因内的碱基排列顺序发生改变。
(2)①基因突变 ②母系遗传 , 后代无一定的性状分离比。
③大量死亡 ④不赞成 ; 抗虫棉不能抵抗所有的害虫。
31.(每空2分,共18分)
(1)一只纯种雄性(雌性)长翅果蝇 ; 一只雌性(雄性)残翅果蝇
(2)自由交配 ; 甲组:在每一代中都要除去残翅果蝇,然后让长翅果蝇自由交配。 乙组:不做任何处理,其它培养条件与实验组相同。
(3)甲、乙两组子七代中长翅果蝇和残翅果蝇在各自种群中的百分比
(4)残翅果蝇 ; B和b基因在各自种群中的基因频率(却一个基因扣一分)
(5)这种人工选择将导致B基因频率增大,b基因频率减小。(却一个基因扣一分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com