
题目列表(包括答案和解析)
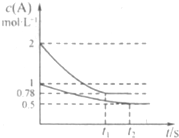
向甲、乙两个容积均为1L的恒容容器中分别充入2 mol A、2 molB和1 molA、l mol B。相同条件下发生如下反应:![]() 。测得两容器中
。测得两容器中![]() 随时间t的变化如图所示。下列说法错误的是
随时间t的变化如图所示。下列说法错误的是![]()
A.![]() 可能等于2也可能等于3
可能等于2也可能等于3![]()
B.若向平衡后的乙容器中充入C,则再次达到平衡时![]() A的体积分数减小
A的体积分数减小![]()
C.单独升高甲容器的温度,可使甲容器中各物质的体![]() 积分数与乙容器相同
积分数与乙容器相同![]()
D.若其它条件不变,使乙容器体积变为2L,则平衡时![]()
乙容器中:![]()
![]()
![]()
![]()
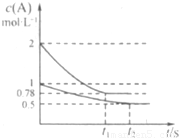
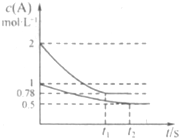 向甲、乙两个容积均为1L的恒容容器中分别充入2mol A、2molB和1molA、l mol B.
向甲、乙两个容积均为1L的恒容容器中分别充入2mol A、2molB和1molA、l mol B.| A.x可能等于2也可能等于3 |
| B.若向平衡后的乙容器中充入C,则再次达到平衡时A 的体积分数增大 |
| C.单独升高甲容器的温度,可使甲容器中各物质的体积分数与乙容器相同 |
| D.若其它条件不变,使乙容器体积变为2L,则平衡时乙容器中:0.25mol?L-1<c(A)<0.5mol?L-1 |
6、B 7、C 8、A 9、D 10、B 11、D 12、A 13、C
26 . ( 13 分) ( 1 ) y的电子式:  ( 2 分) 非极性( l 分)
( 2 分) 非极性( l 分)
( 2 ) 87 ( l 分)
( 3 ) C ( 1 分)
( 4 )碱( 1 分) NH3?H2O  NH4+ + OH一(2分)
NH4+ + OH一(2分)
CO32― + H2O  HCO3― + OH一( 2 分)
HCO3― + OH一( 2 分)
( 5 ) 2NH3 一 6e一+ 6OH― == N2 + 6H2O ( 2 分) 减小( 1 分)
27 . ( 16 分)

( 2 ) ① ⑥ (各 1 分,共 2 分。答 ③ 不扣分,其余有错扣 1 分)
( 3 )羟基( l 分)羧基( 1 分)


28 . ( 16 分) ( 1 ) FeS2 ( 2 分) 沸腾炉(1分)
( 2 )氯酸钾(或KClO3)( 1 分) 镁条(或 Mg ) ( 1 分)

防止产生的Cl2和H2混和发生爆炸( l 分),避免Cl2和NaOH反应,使生成的 NaOH不纯( 1 分)
( 4 ) 6Fe2+ +3ClO一+ 3 H2O == 2Fe(OH)3↓+3Cl―+ 4Fe3 + ( 2分)
( 5 ) I.不合理( 1 分),因为 SO2Cl2为液体,移走 SO2Cl2对反应体系中压强和气体浓度的影响不大(或对反应速率和 SO2Cl2的产率影响不大) ( l 分)
II.不合理( 1 分),该反应为放热反应,升高温度会降低 SO2Cl2的产率,但温度过低,反应速率很小,经济效益较低。因此,应选择适当的温度。( 2 分)
29.( 15 分)
( 1 )增大铜粉与氧接触面积, 使反应迅速、充分( 2 分)
( 2 ) N2 ( 1 分),排出 D中的空气(1分) 关闭 k3( 1 分) 打开 kl、 k2 ( 1 分)
( 3 ) 锥形瓶中玻璃管液面上升( 1 分)
( 4 )Cu 十2NO3―+ 4H + === Cu 2+ + 2NO2↑+ 2H2O ( 2 分)
( 5 ) 向下调节量气管(或及时关闭 k3 ) ( 1分,其它合理答案也可给分)
( 6 ) I . 0.0720 mol / L ( 2 分)
II.有( 1 分) E 装置中生成 100 mL 、0.0720 mol / L硝酸时产生的NO 约为 80.6mL, 而试管中原有 50 mL N2,二者之和小于139.00 mL ,说明生成 NO2 的同时有 NO 生成( 2 分)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com