
题目列表(包括答案和解析)
已知反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入SO2和O2,在一定条件下发生反应。下图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是( )
2SO3(g);ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入SO2和O2,在一定条件下发生反应。下图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是( )

A.SO2的转化率 B.混合气体的密度
C.密闭容器内的压强 D.SO3的体积分数
 2SO3(g);ΔH=-Q kJ/mol(Q>0)。下列说法正确的是
2SO3(g);ΔH=-Q kJ/mol(Q>0)。下列说法正确的是 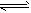 2SO3(g),(正反应是放热反应),达到平衡后,其它条件不变时,只改变下列的某一个条件,将变化的情况(增大、减小、不变)填入空格中。
2SO3(g),(正反应是放热反应),达到平衡后,其它条件不变时,只改变下列的某一个条件,将变化的情况(增大、减小、不变)填入空格中。已知反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10L体积可变的密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10L体积可变的密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )

A.由图甲知,A点SO2的平衡浓度一定为0.04 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
(15分)【化学——选修2:化学与技术】
(一)硫酸厂常用煅烧黄铁矿(FeS2)来制取硫酸。
(1)煅烧黄铁矿的主要化学方程式为 。
(2)SO2和O2的反应为 2SO2(g)+O2(g) 2SO3(g),该反应在体积不变的密闭容器中进行,则下列 (填序号)可作为反应达到平衡的判断依据。
2SO3(g),该反应在体积不变的密闭容器中进行,则下列 (填序号)可作为反应达到平衡的判断依据。
A.v正(SO2)=v正(SO3)
B.各组分的体积分数不再变化
C.反应体系的温度不再变化
D.混合气体的平均相对分子质量不再变化
E.混合气体的密度不再变化
(3)热交换器是实现冷热交换的装置,化学实验中也经常利用热交换来实现某种实验目的。试分析气、液热交换时通常使用的仪器是________________________。(写名称)
(4)硫酸工业所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的试剂是___________________。(填序号)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀硫酸
C. 氨水、酚酞试液 D.碘水、淀粉溶液
(二)实验室常用硫酸厂的烧渣(主要成分是Fe2O3及少量FeS、SiO2)来制备绿矾(FeSO4·7H2O)。
其中测定绿矾产品中FeSO4·7H2O含量的实验步骤为:
a.称取5.2 g产品,溶解,配成250 mL溶液
b.量取25.00 ml待测液于锥形瓶中
c.用硫酸酸化的0. 01 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积35.00 mL。
据此,请分析:
(1)滴定时反应的离子方程式为(完成并配平离子反应方程式)。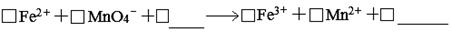
(2)滴定达到终点的标志是 。
(3)产品中FeSO4·7H2O的质量分数为 。
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
B
D
A
A
C
D
B
D
B
B
AC
AD
BC
C
15.(10分,每空2分)
(1)过滤(洗涤) ; 蒸发浓缩、冷却结晶,过滤
(2)连接好装置,从漏斗向量气筒内注入一定量的水,移动漏斗使左、右两侧形成液面高度差。静置后,液面高度不再变化,即表明气密性良好。(其他合理方法均给分)
16.(8分)(1)Al
(2)1.204×1024(或2NA)(2分)
(3)4NH3+5O2 4NO+6H2O(2分)
4NO+6H2O(2分)
(4)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(2分);
 17.(10分,每空2分) (1)HC2O4-+ OH―= C2O42-+ H2O (2)>
17.(10分,每空2分) (1)HC2O4-+ OH―= C2O42-+ H2O (2)>
(3)H2C2O4 CO↑+CO2↑+H2O
(4)温度过低反应速率缓慢;温度过高时,H2C2O4在酸性溶液中会部分分解。(每个点1分 共2分)
(5)C
18.(10分)(1)保护臭氧层(1分)
(3)A(2分)
②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.47kJ•mol-1(2分)
CH3OH(g)+H2O(g) ΔH=-49.47kJ•mol-1(2分)

 (5)B或D(B、D都选给分)(1分)
(5)B或D(B、D都选给分)(1分)
19.(12分,每空2分)
 (1)反应①:加成反应;反应④:取代反应(2) A:CH3CCN; G:
(1)反应①:加成反应;反应④:取代反应(2) A:CH3CCN; G:
(3)B→C;CH3CCOOH CH2=CCOOH+H2O
 |
 |
||||
 |
|||||

|