
题目列表(包括答案和解析)
 CH3OH(g)过程中 能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入amol CO、2amol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
CH3OH(g)过程中 能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入amol CO、2amol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。 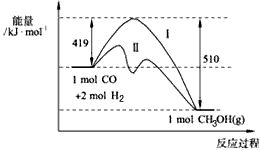
 CH3OH(g) ΔH>-91 kJ·mol-1
CH3OH(g) ΔH>-91 kJ·mol-1 
(3)氧化还原反应中实际上包含氧化和还原两个过程。下面是HNO3发生的一个还原过程的反应式:
NO3-+4H++3e-→NO+2H2O
① KMnO4、Na2CO3、CuO、KI四种物质中的______________(填化学式)能使上述还原过程发生。
②欲用上图II装置通过测定气体生成量测算硝酸被还原的速率,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测定_________________________推算反应速率。
 +3NaOH→3C17H35COONa+
+3NaOH→3C17H35COONa+
 +3NaOH→3C17H35COONa+
+3NaOH→3C17H35COONa+
1.B 2.B 3.B 4.B 5.A 6.BD 7.A 8.A 9.AD 10.A 11.AD
12.CD 13.C 14.A 15.B 16.D 17.D 18.C 19.A 20.B 21.A 22.B
23.(1)E、 、
、 (2)D、
(2)D、 、
、 (3)A、
(3)A、 、
、 (4)D、
(4)D、 、
、 .
.
24.①
②
③
④
25.(1)磺酸基 H亦有较强的酸性
H亦有较强的酸性 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
(2)A  (3)
(3)

26.(1) (2)
(2) (3)②⑤
(3)②⑤
(4)
n 

(2)①

②

(2)①②③④
29.


(2)可以,因为该反应的总反应式为 ,原子利用率=34/34×100%=100%,故可称为理想状态
,原子利用率=34/34×100%=100%,故可称为理想状态
30.(1)A、D (2)除去过量的硫粉 (3)
(4) 生成
生成 :
: ,∴ 未饱和
,∴ 未饱和
(5)B (6)设析出的晶体质量为x(g)
30×1.14-18.9=15.3(g) 
∴ x=23.1(g) www.ks5u.com
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com