
题目列表(包括答案和解析)
(12分)
A.原子数相同、电子总数相同的分子,互称为等电子体。
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1 :2。
请回答:
(1)组成A分子的原子的元素符号是 ;已知E是有毒的有机物,E的熔、沸点比CH4的熔、沸点高,其主要原因是____________________________________。
(2)C的立体结构呈 ____ 形,该分子属于 分子(填“极性”或“非极性”);
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为_______ __________________ 。(不需要写反应条件)
Ⅱ.CO与N2互为等电子体。
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应。
根据下表数据,说明CO比N2活泼的原因是____________________________________。
|
|
| A-B | A=B | A≡B |
| CO | 键能(kJ/mol) | 357.7 | 798.9 | 1071.9 |
| 键能差值kJ/mol) | 441.2 273 | |||
| N2 | 键能(kJ/mol) | 154.8 | 418.4 | 941.7 |
| 键能差值kJ/mol) | 263.6 523.3 |
(5)它们的分子中都包含___________个σ键,______________个π键。
(6)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关。
Ni原子的价电子排布式为 _____ 。Fe(CO)5常温下呈液态,熔点为
-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ____(填晶体类型);Fe(CO)5是配合物,配体是__________ 。
B.茶中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素。某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH至6~7左右,使铝、铁元素以氢氧化物的形式完全沉淀,再加热煮沸30 min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.100mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00mL,计算结果。
请回答下列问题:
步骤 1中,使茶叶灰化时需要用到三角架、泥三角、酒精喷灯、 ___ 、 ____ 等仪器。
步骤2中,改用试剂 _______ (写试剂名称)来调节pH将更为方便;判断沉淀已经洗净的方法是 。
步骤3中,滴定过程中,眼睛应注视 ____________________,被滴定的20 mL滤液中含CO32-的物质的量为 __ mol,试计算原500g茶叶中钙离子的质量分数为 _______ ,计算过程如下:
(12分)
A.原子数相同、电子总数相同的分子,互称为等电子体。
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1 :2。
请回答:
(1)组成A分子的原子的元素符号是 ;已知E是有毒的有机物,E的熔、沸点比CH4的熔、沸点高,其主要原因是____________________________________。
(2)C的立体结构呈 ____ 形,该分子属于 分子(填“极性”或“非极性”);
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为_______ __________________ 。(不需要写反应条件)
Ⅱ.CO与N2互为等电子体。
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应。
根据下表数据,说明CO比N2活泼的原因是____________________________________。
|
|
|
A-B |
A=B |
A≡B |
|
CO |
键能(kJ/mol) |
357.7 |
798.9 |
1071.9 |
|
键能差值kJ/mol) |
441.2 273 |
|||
|
N2 |
键能(kJ/mol) |
154.8 |
418.4 |
941.7 |
|
键能差值kJ/mol) |
263.6 523.3 |
(5)它们的分子中都包含___________个σ键,______________个π键。
(6)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关。
Ni原子的价电子排布式为 _____ 。Fe(CO)5常温下呈液态,熔点为
-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ____(填晶体类型);Fe(CO)5是配合物,配体是__________ 。
B.茶中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素。某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH至6~7左右,使铝、铁元素以氢氧化物的形式完全沉淀,再加热煮沸30 min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.100mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00mL,计算结果。
请回答下列问题:
步骤 1中,使茶叶灰化时需要用到三角架、泥三角、酒精喷灯、 ___ 、 ____ 等仪器。
步骤2中,改用试剂 _______ (写试剂名称)来调节pH将更为方便;判断沉淀已经洗净的方法是 。
步骤3中,滴定过程中,眼睛应注视 ____________________,被滴定的20 mL滤液中含CO32-的物质的量为 __ mol,试计算原500g茶叶中钙离子的质量分数为 _______ ,计算过程如下:
A.原子数相同、电子总数相同的分子,互称为等电子体。
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1 :2。
请回答:
(1)组成A分子的原子的元素符号是 ;已知E是有毒的有机物,E的熔、沸点比CH4的熔、沸点高,其主要原因是____________________________________。
(2)C的立体结构呈 ____ 形,该分子属于 分子(填“极性”或“非极性”);
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为_______ __________________ 。(不需要写反应条件)
Ⅱ.CO与N2互为等电子体。
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应。
根据下表数据,说明CO比N2活泼的原因是____________________________________。
| A-B | A=B | A≡B | ||
| CO | 键能(kJ/mol) | 357.7 | 798.9 | 1071.9 |
| 键能差值kJ/mol) | 441.2 273 | |||
| N2 | 键能(kJ/mol) | 154.8 | 418.4 | 941.7 |
| 键能差值kJ/mol) | 263.6 523.3 | |||
(5)它们的分子中都包含___________个σ键,______________个π键。
(6)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关。
Ni原子的价电子排布式为 _____ 。Fe(CO)5常温下呈液态,熔点为
-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ____(填晶体类型);Fe(CO)5是配合物,配体是__________ 。
B.茶中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素。某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH至6~7左右,使铝、铁元素以氢氧化物的形式完全沉淀,再加热煮沸30 min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.100mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00mL,计算结果。
请回答下列问题:
步骤 1中,使茶叶灰化时需要用到三角架、泥三角、酒精喷灯、 ___ 、 ____ 等仪器。
步骤2中,改用试剂 _______ (写试剂名称)来调节pH将更为方便;判断沉淀已经洗净的方法是 。
步骤3中,滴定过程中,眼睛应注视 ____________________,被滴定的20 mL滤液中含CO32-的物质的量为 __ mol,试计算原500g茶叶中钙离子的质量分数为 _______ ,计算过程如下:
某省2007年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%。阴离子中SO42―和NO3―的质量比为4.13:1,NO3―的比例呈明显上升的趋势。
回答下列问题:
(1)该省大气污染特征是
A.煤烟型
B.机动车尾气型
C.由煤烟型向煤烟型与机动车尾气混合型转化
D.由机动车尾气型向煤烟型与机动车尾气混合型转化
(2)请你提出该省防治酸雨的两条主要措施 ;
(3)某校研究性学习小组拟选择“不同地点空气中二氧化硫的含量分析”的课题进行探究。
①参加该课题的探究,在小组讨论测定地点时,选择的测定地点分别是工厂、学校、村庄(或居民住宅区)、公园(或农田)等。
②通过查阅资料后发现,1994年以前,人们常采用HgCl2、NaCl的混合溶液吸收二氧化硫,1994年国家颁布标准(GB/T15262―94)规定用甲醛溶液吸收二氧化硫。变更吸收剂的原因除了用甲醛溶液的吸收效果比较好处,另一个原因可能是 。
③甲醛溶液吸收二氧化硫以后发生了如下反应,生成稳定的羟基甲碘酸:
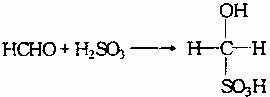
该反应类型属于 。
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.《物质结构与性质》2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主。砷化镓的品胞结构如图10。试回答:
图10
(1)镓的基态原子的电子排布式是 。
(2)砷化镓品胞中所包含的砷原子(白色球)个数为 ,与同一个镓原子相连的砷原子构成的空间构型为 。
(3)下列说法正确的是 (填字母)。
A.砷化镓品胞结构与NaCl相同
B.第一电离能:As>Ga
C.电负性:As>Ga
D.砷化镓晶体中含有配位键
E.GaP与GaAs互为等电子体
(4)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是 。
(5)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式
为 。
B.《实验化学》某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
⑴提出假设
①该反应的气体产物是CO2。
②该反应的气体产物是CO。
③该反应的气体产物是 。
⑵设计方案 如图11所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
图11
⑶查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
请写出该反应的离子方程式: 。
⑷实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为 。
⑸数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式 。 ⑹实验优化 学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是 。
②从环境保护的角度,请你再提出一个优化方案: 。
1.D 2.C 3.C 4.B 5.C 6.C 7.BC 8.BD 9.AC 10.D 11.C
12.BD 13.AC 14.A 15.B 16.D 17.B 18.D 19.B 20.D
21.D 22.C w.w.w.k.s.5.u.c.o.m
23.(1)促进,A (2)甲大
乙用氯化铵溶液稀释后,[ ]增大很多,使
]增大很多,使 的电离平衡向抑制电离的方向移动;
的电离平衡向抑制电离的方向移动; 发生水解,使稀释后的乙溶液的[
发生水解,使稀释后的乙溶液的[ ]增大
]增大
24.(1)第一种组合 A:NaOH B:
第二种组合 A: B:
B:
(2)由于 电离出
电离出 ,使水的电离平衡:
,使水的电离平衡:

 向左移动,使水的电离度小于纯水中水的电离度,而
向左移动,使水的电离度小于纯水中水的电离度,而 溶液中由于
溶液中由于


由于 电离出的
电离出的 与
与 结合生成弱电解质
结合生成弱电解质 ,从而促进水的电离,使水的电离度比纯水中的大.
,从而促进水的电离,使水的电离度比纯水中的大.
25.(1)偏高;空气中的氧气溶于样品中
(2)偏高;使 溶液浓度变低,消耗体积偏大
溶液浓度变低,消耗体积偏大
(3)偏高;使最后读取体积数比实际消耗 溶液体积数大
溶液体积数大
(4)
26.(1)增大w.w.w.k.s.5.u.c.o.m
(2)K值越大,酸性越强
(3)

(4) 上一级电离产生的
上一级电离产生的 对下一级电离有抑制作用
对下一级电离有抑制作用
(5)
27.(1) 和
和 水解均呈弱酸性,可除去金属表面的氧化物
水解均呈弱酸性,可除去金属表面的氧化物
(2) 水溶液中[
水溶液中[ ]很小,不会生成沉淀(或弱酸不能生成强酸).加入氨水时,
]很小,不会生成沉淀(或弱酸不能生成强酸).加入氨水时,

 ,使
,使 电离平衡右移,[
电离平衡右移,[ ]增大,产生沉淀(或
]增大,产生沉淀(或 与
与 生成
生成 ,使[
,使[ ]增大
]增大
(3)在HCl气流中, 抑制
抑制 水解,从而可得到
水解,从而可得到 无水物
无水物
(4)能. ,降低[
,降低[ ],其水解平衡左移,碱性减弱
],其水解平衡左移,碱性减弱
(5) 水解呈碱性,
水解呈碱性, 水解呈酸性,二者混合施用,会促进水解,大量生成易挥发的
水解呈酸性,二者混合施用,会促进水解,大量生成易挥发的 ,从而使氮肥降低肥效
,从而使氮肥降低肥效
 电离呈酸性,与
电离呈酸性,与 混合施用,会产生
混合施用,会产生 或
或 沉淀而丧失肥效.
沉淀而丧失肥效.
硫铵(即硫酸铵)水解呈酸性,长期施用土壤会板结酸化,加消石灰可调节酸度,防止板结.
28.(1)造成测定数值偏高w.w.w.k.s.5.u.c.o.m
(2)
(3)
29.(1) ;
; 、
、
(2)1.90 2.67 5.20
(3)130
分析:(1)因为在浊液中加入HCl溶液至10 mL,沉淀质量一直为 形式存在,继续加入HCl溶液,
形式存在,继续加入HCl溶液, 转变为
转变为 沉淀,加至30 mL时,
沉淀,加至30 mL时, 全部转变为
全部转变为 ,所以在A点的沉淀物为
,所以在A点的沉淀物为 ,在A至B点间,沉淀物为
,在A至B点间,沉淀物为 和
和 的混合物.当加入的HCl溶液超过30 mL时,
的混合物.当加入的HCl溶液超过30 mL时, 和
和 同时溶解.w.w.w.k.s.5.u.c.o.m
同时溶解.w.w.w.k.s.5.u.c.o.m
(2)原混合物中:
 的质量
的质量


 的质量
的质量
NaOH:
①浊液中存在的:
1×0.01 mol
② 消耗的:
消耗的:


③ 消耗的:
消耗的:

0.02 mol×4=0.08 mol
NaOH总质量
(3)从B点开始, 消耗的HCl:0.02 mol×3=0.06 mol
消耗的HCl:0.02 mol×3=0.06 mol
 消耗的HCl:0.02 mol×2=0.04 mol
消耗的HCl:0.02 mol×2=0.04 mol
所消耗HCl溶液的体积为:
Q点HCl溶液总量为:30 mL+100 mL=130 mL
30.(1)
(2)

根据 
过量 为:
为:
20.00 mL水样消耗 为
为
根据得电子数目相等,则有
相当于 为:
为:
 ,即该水样的
,即该水样的
(3)
(4)A,
 www.ks5u.com
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com