
题目列表(包括答案和解析)
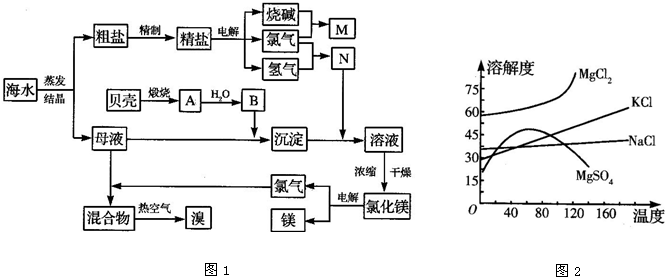
海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:

请回答:
(1)Mg(OH)2中加入盐酸中,要获得MgCl2?6H2O晶体,需要进行的实验操作依次为
;
(2)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是 ;
A.精制饱和食盐水进入阳极室 B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成
(3)母液中常含有MgCl2、NaCl、MgSO4、KCl等,可进一步加工制得一些重要的产品。若将母液加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分是 ;过滤上述晶体后,将滤液降温到30℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到比较纯净的 晶体。
A.![]() 和
和![]() 可存在于同一工厂
可存在于同一工厂
B.Cl-和![]() 一定在不同的工厂
一定在不同的工厂
C.Ag+和Na+可能在同一工厂
D.Fe3+和![]() 存在于同一工厂
存在于同一工厂
|
为了实现我国政府于1997年12月21日对淮河流域环境的治理,某相邻的工厂甲、乙做了横向联合,已知两厂排放的污水经处理后,只溶有浓度较大的Ag+、Ba2+、Fe3+、Na+、Cl-、SO42-、NO3-、OH-中的各不相同的4种离子,若单独排放仍会污染环境,如将两厂的污水按适当的比例混合,沉淀后污水变成无色澄清的溶液排出,则污染程度会大为降低,你认为下列判断中,正确的是 | |
| [ ] | |
A. |
SO42-和NO3-可能存在于同一工厂 |
B. |
Cl-和NO3-一定在不同的工厂 |
C. |
Ag+和Na+可能在同一工厂 |
D. |
Fe3+和SO42-存在于同一工厂 |
为了实现我国政府在1997年12月31日前对淮河流域环境的治理,某甲、乙两相邻的工厂做了横向联合.已知两厂排放的污水经初步处理后,只溶有Ag+、Ba2+、Fe3+、Na+、Cl-、SO42-、NO3-、OH-中的各不同的4种离子(设各离子浓度比较大),若单独排放仍会造成环境污染,如将两厂的污水按适当的比例混合,沉淀后污水变成无色澄清的硝酸钠溶液排出,则污染程度会大为降低.你认为下列分析判断正确的是 ( )
A.SO42- 和NO3-可存在于同一工厂 B.Cl-和NO3-一定在不同的工厂
C.Ag+和Na+可能在同一工 D.Na+和NO3-来自同一工厂
1.B 2.C 3.C 4.B 5.B 6.C 7.C 8.B 9.C 10.AC 11.AD 12.D
13.B 14.A 15.B 16.D 17.B 18.B 19.D 20.D 21.C 22.C
23.(1) ;
; ;(2)HCl;
;(2)HCl; ;(3)HCl、
;(3)HCl、 、
、
24.(1) 、
、 、
、 ;(2)铁粉,Ag (3)
;(2)铁粉,Ag (3) 、
、 、
、 、
、 ;
;
25.D的式量比C大16,猜想Y是 .
. 的连锁反应中,中心元素的价态接连升高,且可能出现一种这样的中心元素,猜想中心元素是硫或氮.
的连锁反应中,中心元素的价态接连升高,且可能出现一种这样的中心元素,猜想中心元素是硫或氮.
正盐A既能与强酸反应,又能跟强碱反应,且生成硫或氮的化合物,说明A是弱酸的铵盐
(1)

 (2)
(2) (3)
(3)
(4) 或
或
26.(1)Fe、C、Si、Al (2)Fe、C  、
、
 、
、
 、
、
(3)
(4)

27.(1)Mg  C
C  MgO CO (2)
MgO CO (2) Fe
Fe 



(3) ,
,

 ,
,
29.(1) (2)设金属元素的原子量为x
(2)设金属元素的原子量为x

x+16 44
 x=40,该金属元素是Ca,氧化物E的化学式是CaO
x=40,该金属元素是Ca,氧化物E的化学式是CaO
(3) ,设G的分子量为y,则
,设G的分子量为y,则 ,y=44,若G
,y=44,若G
分子中含有1个O原子,则44-16=28,28是N原子量的2倍,则G是 ,若G分子中含2个O原子,则44-32=12,则G是
,若G分子中含2个O原子,则44-32=12,则G是 ,不合题意
,不合题意
(4) ,
,
30.(1)由于向溶液中滴加盐酸,无现象,再滴加 溶液,产生白色沉淀.所以,R必定是硫酸根;R的化学式为
溶液,产生白色沉淀.所以,R必定是硫酸根;R的化学式为
(2)



b+34 18 18
解得 b=24,∴ B是镁元素

x∶y∶z=0.01∶0.01∶0.06=l∶1∶6
∴ x=1;y=1;z=6
(3)A的原子量为 ,∴ A是钾元素
,∴ A是钾元素
A元素的名称是钾
(4)复盐的化学式为
(5)焰色反应 www.ks5u.com
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com