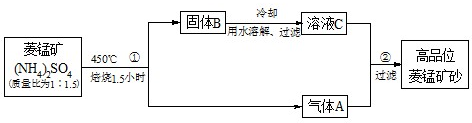
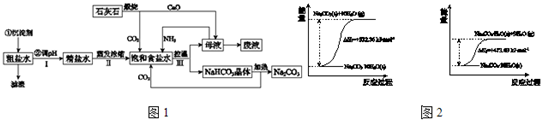
(2009?中山模拟)某研究性学习小组学习了工业“侯氏制碱法”的原理后:
[提出问题]能否在实验室模拟“侯氏制碱法”中制取NaHCO
3的过程呢?
[实验原理]写出候氏制碱法反应的化学方程式为
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
.[实验验证]如图是该学习小组进行模拟实验时所用到的部分主要装置.
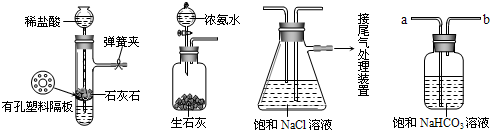
请回答下列问题:
(1)检验A装置气密性的方法是:塞紧带长颈漏斗的橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,若
漏斗中与试管中的液(水)面差保持不再变化或漏斗中的液(水)面不再下降;
漏斗中与试管中的液(水)面差保持不再变化或漏斗中的液(水)面不再下降;
,说明装置不漏气.
(2)D是连接在装置A与装置C之间的气体净化装置,进气口是
a
a
(填a或b),D的作用是除去
HCl
HCl
气体.可否将瓶内试剂换为碳酸钠溶液
否
否
(填“可”“否”).
(3)实验时先向饱和NaCl溶液中通入较多的
NH3
NH3
,再通入足量的
CO2
CO2
,其原因是
①
①
.(填写序号)
①使CO
2更易被吸收 ②NH
3比CO
2更易制取 ③CO
2的密度比NH
3大
(4)用
过滤
过滤
的方法将生成的NaHCO
3晶体从混合物中分离出来.
如果要制得纯碱,还需发生的反应是(写出反应的化学方程式):
.
[得出结论]利用“侯氏制碱法”在实验室可以制取NaHCO
3.