
题目列表(包括答案和解析)


| aV1-0.5bV 2 |
| 1000 |
| aV1-0.5bV 2 |
| 1000 |
| 3 | 4 |



| ||
| ||
| ||
| ||



| ||
| ||
 2BO3,在一个固定容积为2L的密闭容器中充入0.20mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则v(o2 )=
2BO3,在一个固定容积为2L的密闭容器中充入0.20mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则v(o2 )=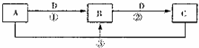
| ||
| ||
| ||
| △ |
| ||
| △ |
 Ⅰ
Ⅰ第Ⅰ卷(选择题 共71分)
一、选择题(本题包括17小题,每小题3分,共51分,每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
答案
C
B
A
D
B
C
B
B
D
C
A
C
A
C
C
D
D
二、选择题(本题共5小题,每小题4分,共20分。每小题只有一个选项符合题意)
题号
18
19
20
21
22
答案
C
C
B
A
D
第Ⅱ卷 (非选择题 共79分)
三、(本题包括3小题,共32分)
23.(8分,每空2分)
(1)③
(2)增大 减小
(3)C
24.(10分,每空2分)
(1)  ;
;
(2) 

(3)112
(4)
25.(14分,每空2分)
(1)
(2)原子晶体 或
或
(3) 
(4)  离子键和共价键
离子键和共价键


四、(本题包括2小题,共24分)
26.(10分,每空2分)
(1) 

(2) 
(3) 
(4)无氧
27.(14分,每空2分)
(1) (2分)
(2分)
 (2)
(2分)
(2)
(2分)
(3)①


 (2分)
(2分)
 ②
② (2分)
(2分)
③
 |

 (2分)
(2分)
④ (2分) (2分)
五、(12分)
28.(12分,化学方程式2分,每空2分)
(1)石灰乳原料丰富,成本低
(2)  (或氯化镁) 过滤 洗涤
(或氯化镁) 过滤 洗涤
(3)圆底烧瓶 制备干燥的 气体,抑制氯化镁水解
气体,抑制氯化镁水解
六、(11分)
29.(1)①硫氰化钾溶液(2分)②1,5,8,1,5,4(2分) ③不可以(1分)


 ,所以不可以服用。(4分)
,所以不可以服用。(4分)
(2)  (2分)
(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com