
题目列表(包括答案和解析)

反应体系中各组分的部分性质见下表:
气体 | 氮气 | 氢气 | 氨 |
熔点/℃ | -210.01 | -252.77 | -77.74 |
沸点/℃ | -195.79 | -259.23 | -33.42 |
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程,即反应后通过把混合气体的温度降低到____________,使混合气体分离出产品,N2、H2继续循环。写出该反应的化学平衡常数表达式:K=____________。
(2)运用化学反应速率和化学平衡的观点说明工业上采用“使混合气体分离出产品,N2、H2继续循环”的生产措施的理由:___________________________________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_____________________________。
(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) ![]() 2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图甲所示。下列叙述正确的是____________。
2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图甲所示。下列叙述正确的是____________。
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773 K下反应至t1时刻,n(H2)比图中d点的值大
(5)1998年希腊亚里斯多德大学的Marncellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨,其实验装置如下图乙。阴极的电极反应式为__________________________________________________________________。


甲 乙
(15分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)  2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:

|
气体 |
氮气 |
氢气 |
氨 |
|
熔点(℃) |
-210.01 |
-252.77 |
-77.74 |
|
沸点(℃) |
-195.79 |
-259.23 |
-33.42 |
反应体系中各组分的部分性质见上表:
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 ℃使混合气体分离出来产品;继续循环的气体是 。
(2)工业上采取用上述(1)操作的目的:
。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________ 。
(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应: N2(g)+3H2(g) 2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是

A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻, n(H2)比上图中d点的值大
(15分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g) 2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
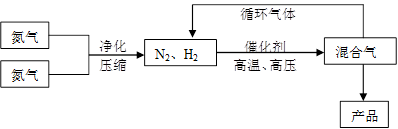
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
反应体系中各组分的部分性质见上表:
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 ℃使混合气体分离出来产品;继续循环的气体是 。
(2)工业上采取用上述(1)操作的目的:
。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________ 。
(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应: N2(g)+3H2(g)2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻, n(H2)比上图中d点的值大
(15分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g) 2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下: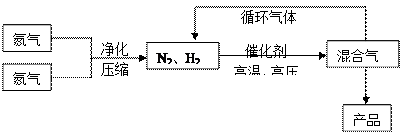
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -1 95.79 95.79 | -259.23 | -33.42 |
 (1)操作的目的:
(1)操作的目的:  2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是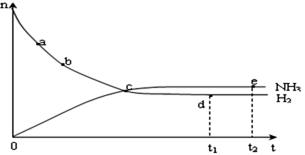
 2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下: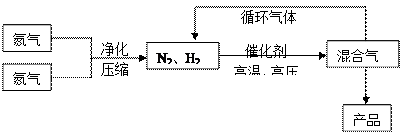
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -1 95.79 95.79 | -259.23 | -33.42 |
 (1)操作的目的:
(1)操作的目的:  2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷。
第Ⅰ卷共18小题,每题6分.共108分。
一、选择题:选对的给6分,选错的或未选得给0分。
1.B 2.C 3.B 4.C 5.D 6.B 7.C 8.D 9.D 10.D 11.D 12.A
二、选择题:全部选对的给6分,选对但不全的给3分,有选错得或未选的给0分。
13.C 14.A 15.D 16.B、C 17.B 18.A、C
第Ⅱ卷必考部分共9题,共157分。
19.(18分)
解:⑴20.30 (1分) ⑵①S1/2T(2分) ;② 9.71~9.73(1分) ③阻力作用(2分)
%20理科综合(二).files/image095.gif) (3)①电路图如图所(左) (3分)
(3)①电路图如图所(左) (3分)
②电流表选0.6A量程(2分)
%20理科综合(二).files/image097.jpg) ③如图(右) (3分)
③如图(右) (3分)
④0.40 ; 2.4 (4分)
20.(15分)
解:由图乙得小滑块在点A、%20理科综合(二).files/image099.gif) 之间做简谐运动的周期为
之间做简谐运动的周期为%20理科综合(二).files/image101.gif) (2分)
(2分)
由单摆振动周期公式%20理科综合(二).files/image103.gif) (1分),得半球形容器半径为
(1分),得半球形容器半径为%20理科综合(二).files/image105.gif) (2分).
(2分).
在最高点A,有
%20理科综合(二).files/image107.gif) ,(2分)
,(2分)
在最低点B,有%20理科综合(二).files/image109.gif) (2分)
(2分)
从点A到点B过程中,滑块机械能守恒,则%20理科综合(二).files/image111.gif) (2分)
(2分)
联立解得%20理科综合(二).files/image113.gif) =0. 99,m=0. 05 kg. (2分)
=0. 99,m=0. 05 kg. (2分)
滑块的机械能为%20理科综合(二).files/image115.gif) (2分)
(2分)
21.(19分)
解:(1)在0~0.3 s时间内感应电动势E1=%20理科综合(二).files/image117.gif) πr2=6.28×10-3V (2分)
πr2=6.28×10-3V (2分)
在0.3s~0.5 s时间内感应电动势E2=%20理科综合(二).files/image119.gif) πr2=9.42×10-3V
(2分)
πr2=9.42×10-3V
(2分)
%20理科综合(二).files/image120.gif) (2)在0~0.3 s时间内
(2)在0~0.3 s时间内 %20理科综合(二).files/image122.gif) =
=
在0.3s~0.5 s时间内 %20理科综合(二).files/image124.gif) =1.5 A (2分)
=1.5 A (2分)
i-t图象如答图2所示。 (2分)
(3)在0~0.3s内,圆环中产生的热量Q1=%20理科综合(二).files/image126.gif) ·2πrR0t1=1.88×10-3J (3分)
·2πrR0t1=1.88×10-3J (3分)
在0.3s~0.5s内,圆环中产生的热量Q2=%20理科综合(二).files/image128.gif) ·2πrR0 t2=2.83×10-3J (3分)
·2πrR0 t2=2.83×10-3J (3分)
在0~10s内圆环中产生的热量Q=20(Q1 +Q2)=9.42×10-2J (3分)
说明:其他解法正确也得分,数值计算问题不重复扣分。
22.(20分)
解:(1)由题意知,要使y轴右侧所有运动粒子都能打在MN上,其临界条件为:沿y轴方向运动的粒子做类平抛运动,且落在M或N点。
MO´=L/2=vt a=qE0/m OO´=L/2=at2/2
联立解得 E0=4mv2/qL (4分)
由动能定理知 qE0×%20理科综合(二).files/image130.gif) =Ek-
=Ek-%20理科综合(二).files/image132.gif) (2分)
(2分)
所以有 Ek=%20理科综合(二).files/image134.gif) (2分)
(2分)
(2)由题意知,要使板右侧的MN连线上都有粒子打到,粒子轨迹直径的最小值为MN板的长度L。 (2分)
由R=L/2=mv/qB0得 B0=2mv/qL (2分)
放射源O发射出的粒子中,打在MN板上的粒子的临界径迹如右图所示。 (2分)
∵OM=ON,且OM⊥ON,∴OO1⊥OO2 (2分)
∴v1⊥v2 (2分)
∴放射源O放射出的所有粒子中只有1/4打在MN板的左侧。(2分)%20理科综合(二).files/image136.jpg)
23.(15分)
解:(1)%20理科综合(二).files/image137.gif) (2分)
(2分) %20理科综合(二).files/image138.gif) (2分)
(2分)
(2)NH3?H2O%20理科综合(二).files/image139.gif) NH4++OH?(3分)
NH4++OH?(3分)
(3)1∶1(2分)
(4)①NH4++H2O%20理科综合(二).files/image139.gif) NH3?H2O+H+(3分)
NH3?H2O+H+(3分)
②3Cu+8H++2NO3?==3Cu2++2NO↑+4H2O(3分)
24.(15分)
解:(1)四周期ⅡB族(1分);
MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S¯+6H2O (2分) ,
Al2O3+6H+=2Al3++3H2O(2分) , 加热(1分)
(2)Zn+Cu2+=Cu+Zn2+ Zn+Cd2+=Cd+Zn2+ Zn+2Fe3+=2Fe2++Zn2+ (3分)
(3)Fe(OH)3,Al(OH)3;
(2分,漏写1分)
(4)阴极(1分);Zn2++2e-=Zn(1分)
(5)从环境保护角度评价:无SO2对大气的污染;从能量消耗角度评价:无高温焙烧热污染,不需要高温焙烧节约燃料。(2分)
%20理科综合(二).files/image140.gif) 25.(15分)
25.(15分)
解:(1)-33.42℃(1分), N2,H2(2分), (2分)
(2)增大氮气和氢气的浓度有利于增大反应速率(2分);减小氨气的浓度,增大氮气和氢气的浓度均有利于平衡向正反应方向移动(2分)
(3)N2(g)+3H2(g)%20理科综合(二).files/image060.jpg) 2NH3(g);△H= ―92.4kJ/mol(2分)
2NH3(g);△H= ―92.4kJ/mol(2分)
(4)AD(2分)
(5)N2+6 H++6e-=2NH3(2分)
26.(25分)
解:I.(1)加快(1分) 酵母菌无氧呼吸产生CO2能供给小球藻进行光合作用(1分)
(2)减慢 (1分) 乳酸菌无氧呼吸不产生CO2 (1分)
(3)(在光照强度为零时)小球藻呼吸作用吸收的氧气量 (2分)
(4)零(1分) 呼吸作用吸收的氧气量等于光合作用产生的氧气量(2分)
(5)光照强度 (2分)
(6)F试管中缺少镁元素,影响叶绿素的正常合成,其光合作用效率就比E试管低(3分)。
II.(1)(负)反馈(1分)
(2) b (1分) 协同(1分) 皮肤冷觉感受器 (1分)
下丘脑体温调节中枢%20理科综合(二).files/image142.jpg) 立毛肌(2分)
立毛肌(2分)
(3)外界环境因素(1分) 细胞代谢活动(1分)
(4)神经系统分泌的神经递质作用于免疫系统,使人体免疫能力下降(2分)
(5)信号分子(或神经递质、激素和免疫因子)(1分)
27.(15分)
解:解析:主要涉及到生态系统、种群、群落、育种等知识点,综合性强,考查范围广。该玉米农田属于农田生态系统。作为第一营养级的玉米,其能量流动一般有3条途径:一是大部分用于自身的呼吸作用,二是通过食物链被下一营养级所同化,三是被分解者分解和未利用的一部分。对消费者处理的主要目的是帮助人们合理地调整生态系统中的能量流动关系,使能量持续高效地流向对人类最有益的部分(玉米)。当生态系统处于相对稳定状态时,蝗虫的种群数量一般处于K值,此时种群数量的增长率为0。根据题意,通过花药离体培养和秋水仙素处理后,得到正常株(AABB)、雄株(aaBB)、雌株(AAbb、aabb)三种表现型;选取多株雌株玉米(AAbb、aabb)与雄株(aaBB)玉米分别杂交,若杂交后代只有正常株(AaBb),则亲本为符合生产要求的纯合体雌株(AAbb)和雄株(aaBB);若后代有雌株和雄株,则亲本不符合生产要求的纯合体雌株和雄株。
参考答案:⑴)生态系统的成分(非生物的物质和能量、生产者、消费者、分解者)、食物链和食物网(2分)
⑵自身的呼吸作用和被下一营养级所同化 (2分) 帮助人们合理地调整生态系统中的能量流动关系,使能量持续高效地流向对人类最有益的部分(玉米)(2分)
⑶信息传递能调节生物的种间关系,以维持生态系统的稳定性抵抗力(1分) 次生演替(1分)
⑷标志重捕法(1分) 0(1分)
⑸ AAbb、aaBB⑹①选取正常植株的花粉,进行花药离体培养,得到单倍体幼苗;②用适宜浓度的秋水仙素溶液处理单倍体玉米幼苗,得到纯合体二倍体玉米植株的表现型为正常株、雄株、雌株;③选取多株雌株玉米与雄株玉米分别杂交,若杂交后代只有正常株,则亲本为符合生产要求的纯合体雌株和雄株;若后代有雌株和雄株,则亲本不符合生产要求的纯合体雌株和雄株(5分)
第Ⅱ卷选考部分共5题,共35分。其中,第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答,若第28、29题都作答,则按第28题计分,若第30、31题都作答,则按第30题计分;第32题为生物题,是必答题。请将答案都填写在答题卡选答区域得指定位置上。
28.(12分)
(1)C (2)A
29.(12分)
(1)B (2)B、C
30.(13分)
解:(1)O2- O22-(或O2-、O3-)(2分) (2)氮(1分) 1s22s22p3(2分)
(3)Si(1分) 原子(1分)
(4)甲烷(1分) 正四面体(1分) %20理科综合(二).files/image144.gif) (2分) sp3 (2分)
(2分) sp3 (2分)
31.(13分)
%20理科综合(二).files/image145.gif) 解:⑴ ③⑤⑦ (2分); ②④ (2分)
解:⑴ ③⑤⑦ (2分); ②④ (2分)
|