
题目列表(包括答案和解析)
 C(s)+4D(g);△H=-Q kJ/lmol下列分析错误的是( )
C(s)+4D(g);△H=-Q kJ/lmol下列分析错误的是( )
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右图所示,根据下图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右图所示,根据下图回答下列问题:

①2SO2(g)+O2(g) 2SO3(g)的△H__________0(填“>”或“<”),
2SO3(g)的△H__________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是???????? 。
A.体系的密度不发生变化???? ????????????? ? B.SO2与SO3的体积比保持不变
C.体系中硫元素的质量百分含量不再变化??? ?? D.单位时间内转移4 mol 电子,同时消耗2 mol SO3
E.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

图1 ????? ? ? 图2?? ???? ? 图3
①该反应的平衡常数表达式为?????????? ,升高温度,平衡常数????????? (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)=??????? ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为??????? (填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 ????? 点,温度T1 ?? T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈???? 性,所得溶液中c(H+)- c(OH-)=??????????? (填写表达式)(已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图 所示,根据图回答下列问题:
所示,根据图回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)的△H__________0(填“>”或“<”)。
2SO3(g)的△H__________0(填“>”或“<”)。
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是 。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

图1 图2 图3
①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 。
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈 性,所得溶液中c(H+)- c(OH-)= (已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图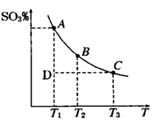 所示,根据图回答下列问题:
所示,根据图回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)的△H__________0(填“>”或“<”)。
2SO3(g)的△H__________0(填“>”或“<”)。
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是 。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。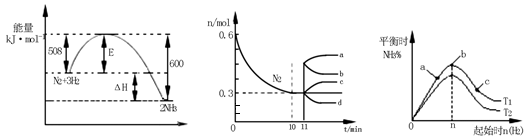
图1 图2 图3
①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 。
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈 性,所得溶液中c(H+)- c(OH-)= (已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)
(17分)运用化学反应原理研究碳的化合物具有重要意义。
(1)常温下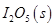 可用于检测CO,反应原理为:
可用于检测CO,反应原理为: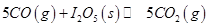
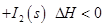 。向2L密闭容器中加入足量
。向2L密闭容器中加入足量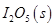 ,并通人1molCO,CO2的体积分数
,并通人1molCO,CO2的体积分数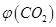 随时间的变化如下图所示。
随时间的变化如下图所示。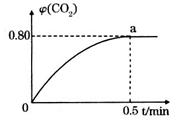
①0~0.5min内的平均反应速率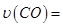 _____________。
_____________。
②保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则下列说法正确的是____________(填代号)。
a.生成I2的质量为原来的2倍
b.混合气体的平均摩尔质量不变
c.达到平衡的时间为原来的2倍
d.混合气体的密度不变
③反应达a点时,欲增大容器中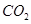 的体积分数
的体积分数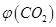 ,可采取的措施为____________。
,可采取的措施为____________。
(2)以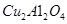 为催化剂,可以将
为催化剂,可以将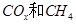 的混合气体直接转化为乙酸。
的混合气体直接转化为乙酸。
①若该反应的原子利用率为100%,则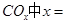 ______________。
______________。
②在25℃下,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,若两溶液恰好完全反应,则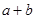 ________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
(3)利用反应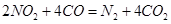 可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷。
第Ⅰ卷共18小题,每题6分.共108分。
一、选择题:选对的给6分,选错的或未选得给0分。
1.B 2.C 3.B 4.C 5.D 6.B 7.C 8.D 9.D 10.D 11.D 12.A
二、选择题:全部选对的给6分,选对但不全的给3分,有选错得或未选的给0分。
13.C 14.A 15.D 16.B、C 17.B 18.A、C
第Ⅱ卷必考部分共9题,共157分。
19.(18分)
解:⑴20.30 (1分) ⑵①S1/2T(2分) ;② 9.71~9.73(1分) ③阻力作用(2分)
%20理科综合(二).files/image095.gif) (3)①电路图如图所(左) (3分)
(3)①电路图如图所(左) (3分)
②电流表选0.6A量程(2分)
%20理科综合(二).files/image097.jpg) ③如图(右) (3分)
③如图(右) (3分)
④0.40 ; 2.4 (4分)
20.(15分)
解:由图乙得小滑块在点A、%20理科综合(二).files/image099.gif) 之间做简谐运动的周期为
之间做简谐运动的周期为%20理科综合(二).files/image101.gif) (2分)
(2分)
由单摆振动周期公式%20理科综合(二).files/image103.gif) (1分),得半球形容器半径为
(1分),得半球形容器半径为%20理科综合(二).files/image105.gif) (2分).
(2分).
在最高点A,有
%20理科综合(二).files/image107.gif) ,(2分)
,(2分)
在最低点B,有%20理科综合(二).files/image109.gif) (2分)
(2分)
从点A到点B过程中,滑块机械能守恒,则%20理科综合(二).files/image111.gif) (2分)
(2分)
联立解得%20理科综合(二).files/image113.gif) =0. 99,m=0. 05 kg. (2分)
=0. 99,m=0. 05 kg. (2分)
滑块的机械能为%20理科综合(二).files/image115.gif) (2分)
(2分)
21.(19分)
解:(1)在0~0.3 s时间内感应电动势E1=%20理科综合(二).files/image117.gif) πr2=6.28×10-3V (2分)
πr2=6.28×10-3V (2分)
在0.3s~0.5 s时间内感应电动势E2=%20理科综合(二).files/image119.gif) πr2=9.42×10-3V
(2分)
πr2=9.42×10-3V
(2分)
%20理科综合(二).files/image120.gif) (2)在0~0.3 s时间内
(2)在0~0.3 s时间内 %20理科综合(二).files/image122.gif) =
=
在0.3s~0.5 s时间内 %20理科综合(二).files/image124.gif) =1.5 A (2分)
=1.5 A (2分)
i-t图象如答图2所示。 (2分)
(3)在0~0.3s内,圆环中产生的热量Q1=%20理科综合(二).files/image126.gif) ·2πrR0t1=1.88×10-3J (3分)
·2πrR0t1=1.88×10-3J (3分)
在0.3s~0.5s内,圆环中产生的热量Q2=%20理科综合(二).files/image128.gif) ·2πrR0 t2=2.83×10-3J (3分)
·2πrR0 t2=2.83×10-3J (3分)
在0~10s内圆环中产生的热量Q=20(Q1 +Q2)=9.42×10-2J (3分)
说明:其他解法正确也得分,数值计算问题不重复扣分。
22.(20分)
解:(1)由题意知,要使y轴右侧所有运动粒子都能打在MN上,其临界条件为:沿y轴方向运动的粒子做类平抛运动,且落在M或N点。
MO´=L/2=vt a=qE0/m OO´=L/2=at2/2
联立解得 E0=4mv2/qL (4分)
由动能定理知 qE0×%20理科综合(二).files/image130.gif) =Ek-
=Ek-%20理科综合(二).files/image132.gif) (2分)
(2分)
所以有 Ek=%20理科综合(二).files/image134.gif) (2分)
(2分)
(2)由题意知,要使板右侧的MN连线上都有粒子打到,粒子轨迹直径的最小值为MN板的长度L。 (2分)
由R=L/2=mv/qB0得 B0=2mv/qL (2分)
放射源O发射出的粒子中,打在MN板上的粒子的临界径迹如右图所示。 (2分)
∵OM=ON,且OM⊥ON,∴OO1⊥OO2 (2分)
∴v1⊥v2 (2分)
∴放射源O放射出的所有粒子中只有1/4打在MN板的左侧。(2分)%20理科综合(二).files/image136.jpg)
23.(15分)
解:(1)%20理科综合(二).files/image137.gif) (2分)
(2分) %20理科综合(二).files/image138.gif) (2分)
(2分)
(2)NH3?H2O%20理科综合(二).files/image139.gif) NH4++OH?(3分)
NH4++OH?(3分)
(3)1∶1(2分)
(4)①NH4++H2O%20理科综合(二).files/image139.gif) NH3?H2O+H+(3分)
NH3?H2O+H+(3分)
②3Cu+8H++2NO3?==3Cu2++2NO↑+4H2O(3分)
24.(15分)
解:(1)四周期ⅡB族(1分);
MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S¯+6H2O (2分) ,
Al2O3+6H+=2Al3++3H2O(2分) , 加热(1分)
(2)Zn+Cu2+=Cu+Zn2+ Zn+Cd2+=Cd+Zn2+ Zn+2Fe3+=2Fe2++Zn2+ (3分)
(3)Fe(OH)3,Al(OH)3;
(2分,漏写1分)
(4)阴极(1分);Zn2++2e-=Zn(1分)
(5)从环境保护角度评价:无SO2对大气的污染;从能量消耗角度评价:无高温焙烧热污染,不需要高温焙烧节约燃料。(2分)
%20理科综合(二).files/image140.gif) 25.(15分)
25.(15分)
解:(1)-33.42℃(1分), N2,H2(2分), (2分)
(2)增大氮气和氢气的浓度有利于增大反应速率(2分);减小氨气的浓度,增大氮气和氢气的浓度均有利于平衡向正反应方向移动(2分)
(3)N2(g)+3H2(g)%20理科综合(二).files/image060.jpg) 2NH3(g);△H= ―92.4kJ/mol(2分)
2NH3(g);△H= ―92.4kJ/mol(2分)
(4)AD(2分)
(5)N2+6 H++6e-=2NH3(2分)
26.(25分)
解:I.(1)加快(1分) 酵母菌无氧呼吸产生CO2能供给小球藻进行光合作用(1分)
(2)减慢 (1分) 乳酸菌无氧呼吸不产生CO2 (1分)
(3)(在光照强度为零时)小球藻呼吸作用吸收的氧气量 (2分)
(4)零(1分) 呼吸作用吸收的氧气量等于光合作用产生的氧气量(2分)
(5)光照强度 (2分)
(6)F试管中缺少镁元素,影响叶绿素的正常合成,其光合作用效率就比E试管低(3分)。
II.(1)(负)反馈(1分)
(2) b (1分) 协同(1分) 皮肤冷觉感受器 (1分)
下丘脑体温调节中枢%20理科综合(二).files/image142.jpg) 立毛肌(2分)
立毛肌(2分)
(3)外界环境因素(1分) 细胞代谢活动(1分)
(4)神经系统分泌的神经递质作用于免疫系统,使人体免疫能力下降(2分)
(5)信号分子(或神经递质、激素和免疫因子)(1分)
27.(15分)
解:解析:主要涉及到生态系统、种群、群落、育种等知识点,综合性强,考查范围广。该玉米农田属于农田生态系统。作为第一营养级的玉米,其能量流动一般有3条途径:一是大部分用于自身的呼吸作用,二是通过食物链被下一营养级所同化,三是被分解者分解和未利用的一部分。对消费者处理的主要目的是帮助人们合理地调整生态系统中的能量流动关系,使能量持续高效地流向对人类最有益的部分(玉米)。当生态系统处于相对稳定状态时,蝗虫的种群数量一般处于K值,此时种群数量的增长率为0。根据题意,通过花药离体培养和秋水仙素处理后,得到正常株(AABB)、雄株(aaBB)、雌株(AAbb、aabb)三种表现型;选取多株雌株玉米(AAbb、aabb)与雄株(aaBB)玉米分别杂交,若杂交后代只有正常株(AaBb),则亲本为符合生产要求的纯合体雌株(AAbb)和雄株(aaBB);若后代有雌株和雄株,则亲本不符合生产要求的纯合体雌株和雄株。
参考答案:⑴)生态系统的成分(非生物的物质和能量、生产者、消费者、分解者)、食物链和食物网(2分)
⑵自身的呼吸作用和被下一营养级所同化 (2分) 帮助人们合理地调整生态系统中的能量流动关系,使能量持续高效地流向对人类最有益的部分(玉米)(2分)
⑶信息传递能调节生物的种间关系,以维持生态系统的稳定性抵抗力(1分) 次生演替(1分)
⑷标志重捕法(1分) 0(1分)
⑸ AAbb、aaBB⑹①选取正常植株的花粉,进行花药离体培养,得到单倍体幼苗;②用适宜浓度的秋水仙素溶液处理单倍体玉米幼苗,得到纯合体二倍体玉米植株的表现型为正常株、雄株、雌株;③选取多株雌株玉米与雄株玉米分别杂交,若杂交后代只有正常株,则亲本为符合生产要求的纯合体雌株和雄株;若后代有雌株和雄株,则亲本不符合生产要求的纯合体雌株和雄株(5分)
第Ⅱ卷选考部分共5题,共35分。其中,第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答,若第28、29题都作答,则按第28题计分,若第30、31题都作答,则按第30题计分;第32题为生物题,是必答题。请将答案都填写在答题卡选答区域得指定位置上。
28.(12分)
(1)C (2)A
29.(12分)
(1)B (2)B、C
30.(13分)
解:(1)O2- O22-(或O2-、O3-)(2分) (2)氮(1分) 1s22s22p3(2分)
(3)Si(1分) 原子(1分)
(4)甲烷(1分) 正四面体(1分) %20理科综合(二).files/image144.gif) (2分) sp3 (2分)
(2分) sp3 (2分)
31.(13分)
%20理科综合(二).files/image145.gif) 解:⑴ ③⑤⑦ (2分); ②④ (2分)
解:⑴ ③⑤⑦ (2分); ②④ (2分)
|