
题目列表(包括答案和解析)
某芳香族化合物A在一定条件下能发生如下图转化,部分产物已略去。气体F对
氢气的相对密度为22。

请按要求回答下列问题:
(1)E的分子式是_____________;B的结构式为_____________;C的含氧官能团有(写名称)
_____________;反应⑦的反应类型是_____________。
(2)设计反应①、⑥的目的是____________________________________________。
(3)写出下列反应的化学方程式:
反应④:_________________________________________________________________;
反应⑤:_________________________________________________________________。
(4)A的结构简式是_______________________________________。
(5)己知有机物H比C的分子少一个CH2,且H具有如下性质:①遇FeCl3溶液发生显色反应;②一
定条件下能发生水解反应;③分子中苯环上仅有两个相邻取代基。则H同分异构体的数目为_________;
其结构简式之一为____________________________________________________。
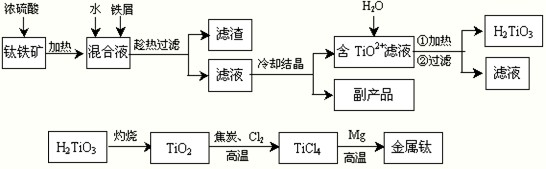
 H2TiO3+2H+
H2TiO3+2H+ H2TiO3+2H+
H2TiO3+2H+
| ||
| c(TiCl4)×c2(CO) |
| c2(Cl2) |
| c(TiCl4)×c2(CO) |
| c2(Cl2) |
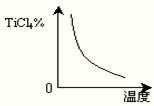
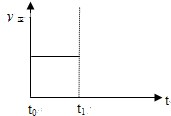 (2009?广州模拟)水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
(2009?广州模拟)水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:| 容器编号 | c(H2O)/mol?L-1 | c(CO)/mol?L-1 | c(H2)/mol?L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.60 0.60 |
ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正 > > ν逆 |
(5分)已知一定物质的量浓度的稀硫酸溶液100mL与足量的铁粉充分反应,生成4.48L氢气(标准状况下)。求
⑴有多少克铁参加反应
⑵该稀硫酸的物质的量浓度www.7caiedu.cn
(5分)已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl 溶液、Fe
溶液、Fe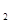 (SO
(SO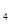 )
)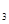 溶液、盐酸。按要求回答下列问题:若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池?
(填“能”或“不能”)。若能,请写出电极反应式:负极
,正极
。若不能,请说明原因
。
溶液、盐酸。按要求回答下列问题:若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池?
(填“能”或“不能”)。若能,请写出电极反应式:负极
,正极
。若不能,请说明原因
。
17,①A:氯 Cl B、铝Al C:氩Ar D:氢H
 |
②
1814.⑴ b
⑵ H
⑶ ① (Mg、Al)
② 镁
b、c
19(1)第二周期、第ⅥA族  (2)O<N<Al<Mg<Na
(2)O<N<Al<Mg<Na
20 n(37Cl)=0.5/(1+3)=0.125mol.
m(37Cl)=0.125x37=4.625(g)
高一年级第一次月考参考答案
17,①A:氯 Cl B、铝Al C:氩Ar D:氢H
 |
②
1814.⑴ b
⑵ H
⑶ ① (Mg、Al)
② 镁
b、c
19(1)第二周期、第ⅥA族  (2)O<N<Al<Mg<Na
(2)O<N<Al<Mg<Na
20 n(37Cl)=0.5/(1+3)=0.125mol.
m(37Cl)=0.125x37=4.625(g)
高一年级第一次月考参考答案
17,①A:氯 Cl B、铝Al C:氩Ar D:氢H
 |
②
1814.⑴ b
⑵ H
⑶ ① (Mg、Al)
② 镁
b、c
19(1)第二周期、第ⅥA族  (2)O<N<Al<Mg<Na
(2)O<N<Al<Mg<Na
20 n(37Cl)=0.5/(1+3)=0.125mol.
m(37Cl)=0.125x37=4.625(g)
高一年级第一次月考参考答案
17,①A:氯 Cl B、铝Al C:氩Ar D:氢H
 |
②
1814.⑴ b
⑵ H
⑶ ① (Mg、Al)
② 镁
b、c
19(1)第二周期、第ⅥA族  (2)O<N<Al<Mg<Na
(2)O<N<Al<Mg<Na
20 n(37Cl)=0.5/(1+3)=0.125mol.
m(37Cl)=0.125x37=4.625(g)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com