
题目列表(包括答案和解析)
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)(mol) | 0.40 | a | 0.20 | c | d | e |
| n(NO2)(mol) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
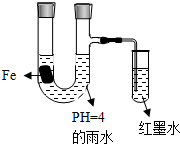 如图装置中,小试管内为红墨水,带有支管的U型管中盛有pH=4的雨水和生铁片.经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面.以下有关解释合理的是( )
如图装置中,小试管内为红墨水,带有支管的U型管中盛有pH=4的雨水和生铁片.经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面.以下有关解释合理的是( )| A、生铁片中的碳是原电池的负极,发生还原反应 | B、雨水酸性较强,生铁片始终发生析氢腐蚀 | C、墨水液面回升时,正极反应式为:O2+2H2O+4e-=4OH- | D、U型管中溶液pH逐渐减小 |
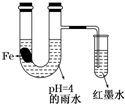 如图装置中,小试管内为红墨水,带有支管的U型管中盛有pH=4的雨水和生铁片.经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面.以下有关解释合理的是( )
如图装置中,小试管内为红墨水,带有支管的U型管中盛有pH=4的雨水和生铁片.经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面.以下有关解释合理的是( )(12分)在80℃时,将0.40 mol的N2O4气体充入1 L固定容积的密闭容器中发生反应:N2O4  2NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
2NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)(mol) | 0.40 | a | 0.20 | c | d | e |
| n(NO2)(mol) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
 衡后N2O4的转化率将 (填“增大”、“减小”或“不变”)。
衡后N2O4的转化率将 (填“增大”、“减小”或“不变”)。(12分)在80℃时,将0.40 mol的N2O4气体充入1 L固定容积的密闭容器中发生反应:N2O4 2 NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)(mol) | 0.40 | a | 0.20 | c | d | e |
| n(NO2)(mol) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)在20s — 40s之间,用N2O4表示的平均反应速率为 。
(2)在80℃时该反应的平衡常数K= 。
(3)要增大该反应的平衡常数,可采取的措施有(填序号) 。
①增大N2O4的起始浓度 ②向混合气体中通入NO2
③使用高效催化剂 ④升高温度
(4)反应进行至100s后若降低温度,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(5)反应进行至100s后若向容器中再充入0.40 mol的N2O4气体,则达到新平衡后N2O4的转化率将 (填“增大”、“减小”或“不变”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com