
题目列表(包括答案和解析)
研究CO2与CH4,反应使之转化为CO和H2,对减缓燃料危机、减小温室效应具有重要的意义。
(1)已知:2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=____________。

(2)在密闭容器中通人物质的量浓度均为0.1mol/L的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图1:
①下列事实能说明该反应一定达到平衡的是 。
a.CO2的浓度不再发生变化
b.υ正(CH4)=2υ逆(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO与H2的物质的量比为1:1
②据图可知,P1、P2、P3、P4由大到小的顺序为 。
③在压强为P4、1100℃的条件下,该反应5min时达到平衡x点,则用CO表示该反应的速率为 ,该温度下,反应的平衡常数为 。
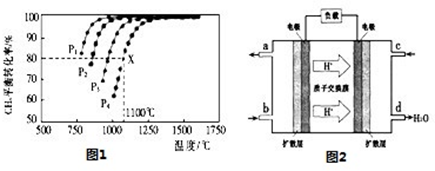
(3)用CO与H2可合成甲醇(CH3OH),以甲醇和氧气反应制成的燃料电池如图2所示,该电池工作程中O2应从 (填“c或一b”)口通人,电池负极反应式为 ,若用该电池电解精炼铜,每得到6. 4g铜,转移电子数目为 。
研究CO2与CH4,反应使之转化为CO和H2,对减缓燃料危机、减小温室效应具有重要的意义。
(1)已知:2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=____________。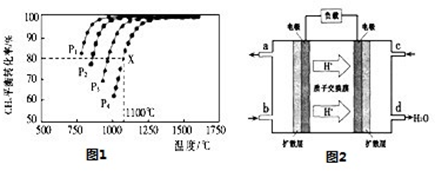
(2)在密闭容器中通人物质的量浓度均为0.1mol/L的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图1:
①下列事实能说明该反应一定达到平衡的是 。
a.CO2的浓度不再发生变化
b.υ正(CH4)=2υ逆(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO与H2的物质的量比为1:1
②据图可知,P1、P2、P3、P4由大到小的顺序为 。
③在压强为P4、1100℃的条件下,该反应5min时达到平衡x点,则用CO表示该反应的速率为 ,该温度下,反应的平衡常数为 。
(3)用CO与H2可合成甲醇(CH3OH),以甲醇和氧气反应制成的燃料电池如图2所示,该电池工作程中O2应从 (填“c或一b”)口通人,电池负极反应式为 ,若用该电池电解精炼铜,每得到6. 4g铜,转移电子数目为 。
I、合成氨对农业生产及国防建设均具有重要意义。
(1)在恒温恒容密闭容器中进行的合成氨反应,N2(g)+3H2(g) ![]() 2NH3(g),下列能表示达到平衡状态的是_______(填序号)。
2NH3(g),下列能表示达到平衡状态的是_______(填序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
II、能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌。而甲醇是未来重要的绿色能源之一。以CH4和H2O为原料,通过下列反应来制备甲醇。
(1)将1.0molCH4和2.0molH2O(g)通入容积为10 L的反应室,在一定条件下发生反应:
CH4(g)+H2O(g)![]() CO(g)+3H2(g),测得在一定的压强下CH4的转化率与温度的关系如下图。
CO(g)+3H2(g),测得在一定的压强下CH4的转化率与温度的关系如下图。

①假设100℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 ;
②100℃时反应的平衡常数为 。
(2)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH2的混合气体在催化剂作用下发生反应CO(g)+2H2(g)![]() CH3OH (g)生成甲醇,平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
CH3OH (g)生成甲醇,平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.c(H2)减小 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡时c(H2)/c(CH3OH)减小
E.平衡常数K增大
(3)已知: 反应:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH= —116 kJ/mol
2Cl2(g)+2H2O(g) ΔH= —116 kJ/mol
H2(g) + Cl2(g) == 2HCl(g) ΔH= —184 kJ/mol
Ⅱ ![]()
![]()
请回答:
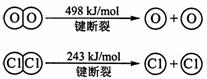
①H2与O2反应生成气态水的热化学方程式是____ ___。
②断开1 mol H—O 键所需能量约为______kJ。
“神七”登天谱写了我国航天事业的新篇章。火箭升空需要高能的燃料,通常用肼(N2H4)作为燃料,N2O4做氧化剂。
(1)已知:N2(g) + 2O2(g) =2NO2(g) △H=+67.7 kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H=-534.0 kJ·mol-1
2NO2(g) N2O4(g) △H=-52.7 kJ·mol-1
N2O4(g) △H=-52.7 kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: 。
(2)工业上可用次氯酸钠与过量的氨反应制备肼,该反应的化学方程式为: 。
(3)一定条件下,在2L密闭容器中起始投入2 mol NH3和4 mol O2发生反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
测得平衡时数据如下:
| 平衡时物质的量(mol) | n(NO) | n(H2O) |
| 温度T1 | 1.6 | 2.4 |
| 温度T2 | 1.2 | 1.8 |
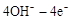 =O2↑+2H2O,则阴极反应为 。有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由 。
=O2↑+2H2O,则阴极反应为 。有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由 。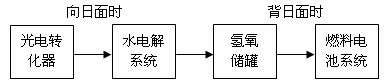
一、选择题(48分)
1.B 2.B 3.D 4.C 5.A 6.A D 7.B C 8.A B
理科综合.files/image211.jpg) 二、实验题(18分)
二、实验题(18分)
9.(1)(6分)
10.红光(4分)
11.(1)R理科综合.files/image068.gif) (或C)(2分) (2)如图(2分)
(或C)(2分) (2)如图(2分)
(3)896.4理科综合.files/image214.gif) (2分) 偏大 (2分)
(2分) 偏大 (2分)
三、计算题(54分)
12.(16分)解:小车固定在地面时,设物体与小车间摩擦力为f,由动能定理
理科综合.files/image216.gif) (1)
(1)
把小车放在光滑水平地面上时,小物体与小车间摩擦力仍为f.设小物体相对小车滑行距离为L时,跟小车相对静止(未能滑离小车)共同速度为V,由动量守恒定律
理科综合.files/image218.gif) (2)
(2)
设这过程小车向前滑行距离为S。由动能定理
对小车有理科综合.files/image220.gif) (3)
(3)
对小物体有理科综合.files/image222.gif)
由(2)(3)(4)解出理科综合.files/image224.gif) (5)
(5)
理科综合.files/image226.gif) 且
且理科综合.files/image228.gif) (6)
(6)
比较(5)(6)解出理科综合.files/image230.gif) ,只要
,只要理科综合.files/image232.gif) 小物体就能滑离小车
小物体就能滑离小车
13.(18分) 解:(1)理科综合.files/image234.gif)
(2)刚释放理科综合.files/image236.gif) 棒时,
棒时,理科综合.files/image238.gif)
理科综合.files/image236.gif) 棒受到安培力为:
棒受到安培力为:理科综合.files/image241.gif)
理科综合.files/image236.gif) 棒受到的种力为:
棒受到的种力为:理科综合.files/image244.gif)
理科综合.files/image246.gif) 棒沿导轨向下加速滑动,既abcd闭合回路的
棒沿导轨向下加速滑动,既abcd闭合回路的理科综合.files/image248.gif) 增大;
增大;
电流也将增大,所以最小电流为:理科综合.files/image250.gif) ;
;
当理科综合.files/image236.gif) 棒的速度达到最大时,回路的电流最大,此时
棒的速度达到最大时,回路的电流最大,此时理科综合.files/image236.gif) 棒的加速度为零。
棒的加速度为零。
由理科综合.files/image254.gif) 得
得理科综合.files/image256.gif)
(3)由:理科综合.files/image258.gif) 得:
得:理科综合.files/image260.gif)
14.解:(20分)(1)带电粒子从原点射出进入匀强磁场,在垂直于磁场的理科综合.files/image262.gif) 平面内做匀速圆周运动由左手定则判断磁场的方向垂直于
平面内做匀速圆周运动由左手定则判断磁场的方向垂直于理科综合.files/image262.gif) 平面指向纸外。从粒子进入电场受力作用而速度偏高分析判断:电场强度方向是平行x轴,沿
平面指向纸外。从粒子进入电场受力作用而速度偏高分析判断:电场强度方向是平行x轴,沿理科综合.files/image265.gif) 轴负方向。
轴负方向。
理科综合.files/image267.jpg)
理科综合.files/image269.gif) 距离应是带电粒子在匀强磁场中作圆周运动的轨迹直径,从
距离应是带电粒子在匀强磁场中作圆周运动的轨迹直径,从理科综合.files/image094.gif) 到
到理科综合.files/image034.gif) 经理半个周期,即:
经理半个周期,即:
理科综合.files/image273.gif) ①
①
理科综合.files/image275.gif) ②
②
解出理科综合.files/image277.gif) ③
③
理科综合.files/image279.gif)
(2)带电粒子以理科综合.files/image281.gif) (大小等于
(大小等于理科综合.files/image077.gif) 的大小)垂直射入匀强电场,受电场力作用而做曲线运动,(相当于平抛运动轨迹)
的大小)垂直射入匀强电场,受电场力作用而做曲线运动,(相当于平抛运动轨迹)
设匀强电场的场强大小为E,粒子射出电场的速度为理科综合.files/image284.gif) ,
,
理科综合.files/image286.gif) ⑤
⑤
理科综合.files/image288.gif) ⑥
⑥
理科综合.files/image290.gif) ⑦
⑦
理科综合.files/image292.gif) ⑧
⑧
射出电场时理科综合.files/image284.gif) 与
与理科综合.files/image295.gif) 轴夹角120°,即与
轴夹角120°,即与理科综合.files/image297.gif) 夹角60°
夹角60°
理科综合.files/image299.gif) ⑨
⑨
由⑤、⑥、⑦、⑧、⑨解出 理科综合.files/image301.gif)
理科综合.files/image303.gif) ①―⑨式子每个2分 结果2分
①―⑨式子每个2分 结果2分
(化学部分)参考答案
1.A 2.B 3.D 4.B 5.C 6.C
7.(14分)
(1)理科综合.files/image305.jpg)
理科综合.files/image307.gif)
(2)第三周期第ⅥA族
理科综合.files/image309.gif)
理科综合.files/image311.gif)
(3)理科综合.files/image313.gif)
8.(18分)
(1)理科综合.files/image315.gif)
(2)羟基 取代反应 消去反应
(3)1:1:3
(4)理科综合.files/image317.jpg)
(5)理科综合.files/image318.jpg)
(生物部分)参考答案
一、单项选择题(每题6分,共36分)
1.A 2.C 3.D 4.C 5.B 6.C
二、非选择题(除标注外,每空2分,共44分)
7.(1)细菌 营养物质消耗尽了
(2) 图画准确 (2分)。 有a、b标示(1分) 捕食
理科综合.files/image320.jpg)
(3)细菌 小球藻 细菌可以为小球藻提供矿质营养与二氧化碳、小球海可以为细菌提供有机营养与氧气
8(一) (1)光反应 色素的数量 二氧化碳含量、温度等
(2) 酶的活性 (3)三碳化合物
(4)
适当降低室内温度 因为在该光照强度以下,
低温时(
8(二)(1) ①切成大小相等的若干小块
②分别加入10ml (等量)过氧化氢溶液
③再分别加入2,4,6个土豆小块
④定时观察记录针筒内体积的变化。
(2)温度 土豆的新鲜程度 注射器的密封性 注射器针筒与活塞之间的摩擦力等(任答两项,其他答案合理也可)
(3)延长、缩短
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com