
题目列表(包括答案和解析)
(1)已知H―H的键能是为436.0kJ?mol-1、Cl―Cl的键能是为242.7kJ?mol-1、H―Cl的键能是为431.8kJ?mol-1
试写出氢气和氯气反应的热化学方程式:
。
(2)已知:2H2(g)+O2(g)===2H2O(g) △H=―483.6 kJ/mol;H2(g)+“氢能”将是未来最理想的新能源。
(1)实验测得,1克氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为 :
A.2H2(g) + O2(g) = 2H2O(l); △H =-142.9 kJ?mol-1
B.H2(g) + 1/2O2(g) = H2O(l); △H =-285.8 kJ?mol-1
C.2H2(g) + O2(g) = 2H2O(l); △H =-571.6kJ?mol-1
D.H2(g) + 1/2O2(g) = H2O(g); △H = -285.8kJ?mol-1
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列反应步骤:
①CaBr2+H2O![]() CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg ![]() HgBr2+H2
HgBr2+H2
③HgBr2+CaO ![]() HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO ![]() 2Hg+O2↑
2Hg+O2↑
你认为该方法的主要缺点是 。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘,。
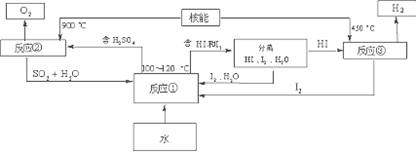
请写出反应①的化学方程式: ;
该法制取氢气最大的优点是: ;
(4)有人认为目前利用氢气作为能源不太现实。请问你认为是否现实? (填“不现实”或“现实”),说明能够支持你的观点的两点理由:, ;
。
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)= CH4(g)+HC≡CH(g)+H2(g);△H1=156.6 kJ?mol-1
CH3CH=CH2(g) =CH4(g)+HC≡CH(g);△H2=32.4 kJ?mol-1
则相同条件下,反应C3H8(g) =CH3CH=CH2(g)+H2(g)的△H=_____kJ?mol-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为____________________________________________________;放电时,CO32-移向电池的_____ __(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol?L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(4)常温下,0.lmol?L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是________________________________________________________(用离子方程式和必要的文字说明)。
下列关于反应能量的说法正确的是( )
A.Zn(s) +CuSO4 (aq) =ZnSO4 (aq) +Cu(s) ; △H = ―216kJ?mol-1 ,反应物总能量>生成物总能量
B.相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2。则2E1>E2
C.l0lkPa 时,2H2 (g)+ O2 (g) =2H2O(1);△H = ―571. 6 kJ?mol-1 ,H2的燃烧热为
571.6kJ?mol-1
D.H+ (aq) +OH-(aq) =H2O(l) ;△H= ―57.3 kJ?mol-1 ,含 1molNaOH 的氢氧化钠溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量
下列关于反应能量的说法正确的是( )
A.Zn(s) +CuSO4 (aq) =ZnSO4 (aq) +Cu(s) ; △H = ―216kJ?mol-1 ,反应物总能量>生成物总能量
B.相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2。则2E1>E2
C.l0lkPa 时,2H2 (g)+ O2 (g) =2H2O(1);△H = ―571. 6 kJ?mol-1 ,H2的燃烧热为
571.6 kJ?mol-1
D.H+ (aq) +OH-(aq) =H2O(l) ;△H= ―57.3 kJ?mol-1 ,含 1molNaOH 的氢氧化钠溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com