
题目列表(包括答案和解析)
(11分)原子序数依次增大的短周期元素A、B、C、D、E、F,其中 A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,F能形成与A相同价态的阴离子,且A离子半径小于F离子。回答:
(1)B元素的名称为 。
(2)A与F可形成两种中学化学常见的化合物,其分子式分别为 和 ;分子空间构型分别为 。
(3)请写出基态原子E的价电子排布式
(4)上述六种元素按电负性从大到小的排列是 (写元素符号表示)。
(5)C、D、E、F元素第一电离能从小到大的排列是 (写元素符号);
(6)A、B、C、D四种元素的简单离子按半径由小到大的顺序为(用离子符号表示)__________________________。
(7)C与A形成的化合物属于 晶体,此化合物和NaCl固体相比较熔点的高低关系为
(用化学式表示大小关系),原因是 。
已知A元素原子的K、L层电子数之和比M、L层电子数之和多一个电子;B元素原子核外电子占有9个轨道,且有1个未成对电子;C元素原子核外3p亚层中3个轨道还需5个电子才能达到全充满.D元素只有两个电子层,且最高化合价与最低化合价的代数和为零;E原子半径最小;F元素最外层电子排布为nSnnPn+1.按要求填写
①B的电子排布式是:________,A、B两元素形成的化合物的晶体类型是________.
②D元素单质的晶体类型是________,C单质的制备方法是:________.
③E和F形成的化合物空间构型为________,该物质比D与E形成的化合物更容易液化的原因是________________________.
(14分)(1)某元素的激发态(不稳定状态)原子的电子排布式为1s2s2p3s3p4s,则该元素基态原子的价电子的轨道表示式为 ;元素符号为 ;其最高价氧化物对应的水化物的化学式是 。水溶液为 性(酸性或碱性)
(2)A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
①化合物甲的空间构型为 电子式 中心原子的杂化方式 键角
②化合物乙中含有的化学键是____________________________
③E单质在一定条件下与甲反应的化学方程式为 。
④用电子式表示ED的形成过程
(14分)(1)某元素的激发态(不稳定状态)原子的电子排布式为1s 2s
2s 2p
2p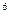 3s
3s 3p
3p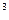 4s
4s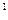 ,则该元素基态原子的价电子的轨道表示式为 ;元素符号为 ;其最高价氧化物对应的水化物的化学
,则该元素基态原子的价电子的轨道表示式为 ;元素符号为 ;其最高价氧化物对应的水化物的化学 式是 。水溶液为 性(酸性或碱性)
式是 。水溶液为 性(酸性或碱性)
(2)A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增 。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
①化合物甲的空间构型为 电子式 中心原子的杂化方式 键角
②化合物乙中含有的化学键是____________________________
③E单质在一定条件下与甲反应的化学方程式为 。
④用电子式表示ED的形成过程
(14分)(1)某元素的激发态(不稳定状态)原子的电子排布式为1s2s2p3s3p4s,则该元素基态原子的价电子的轨道表示式为 ;元素符号为 ;其最高价氧化物对应的水化物的化学式是 。水溶液为 性(酸性或碱性)
(2)A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
①化合物甲的空间构型为 电子式 中心原子的杂化方式 键角
②化合物乙中含有的化学键是____________________________
③E单质在一定条件下与甲反应的化学方程式为 。
④用电子式表示ED的形成过程
说明:1. 文字简答题以关键词到位为准,按点给分;
2. 化学用语书写:(1)方程式未配平不得分、无条件扣一半分值;
(2)化学式书写错误得0分;
3. 写名称或化学式正确的正常给分; 4. 其他合理解法正常给分。
第Ⅰ卷(选择题,共48分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
二、选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
A
C
B
D
A
B
D
B
AC
C
A
BD
D
AD
第Ⅱ卷(非选择题 共72分)
三、(本题包括1小题,共10分)
15.(10分)(1)NH4[CuCl2] =CuCl↓+NH4Cl(1分),避免CuCl溶于水而造成损耗,洗去晶体表面的杂质离子及水分(1分)。(2)蒸馏(1分),NH4Cl、HNO3(2分)。 (3) B(2分) (4)氯化铵溶于水吸收大量热量,造成反应液温度降低(1分)。 烧瓶上方红棕色气体逐渐变为无色(1分),a或c(1分)(答a或答c给分)
四、(本题包括2小题,共18分)
16.(8分)(1)六 ⅣA (各1分,共2分)(2)不变(2分)
(3) Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O (2分)
(4)Na2S2O3标准溶液浓度和滴定溶液体积(2分)
17.(10分)(1)CH4+H2O
 CO+3H2(2分)(2)n (2分)(3)Fe2O3?H2O(2分)
CO+3H2(2分)(2)n (2分)(3)Fe2O3?H2O(2分)
 |
(4) 优点是:NaOH可以循环利用,同时获得副产品氢气。(各2分,共4分,优点答到“NaOH可以循环利用”即可)
五、(本题包括1小题,共10分)
18.(10分)(1)氯化铵(2分)
(2)原因是降低KH2PO4溶解度,使其析出后,降低了生成物浓度,(同时生成的HCl与三正丁胺反应,也降低了HCl的浓度),使平衡向正反应方向移动。(2分,答到一点即可)。分离出氯化氢(2分,其他合理答案均给分)(3)50―60均可,95%(填近似值即可)(各2分,共4分)
六、(本题包括1小题,共12分)
19.(12分)(1)与生成的硫酸反应,促进平衡向正反应方向移动。(2分)
(2) (2分)
(2分)
(3)2(1分)
(4) (2分)
(2分)
(5)保护A中的酚羟基。(2分)
(6)(3分,第一步正确得2分,完全正确得3分)

|